不活動や糖尿病による筋萎縮のメカニズムを解明 サルコペニア・フレイルの予防治療法の開発へ
血管は酸素や栄養を運ぶだけでなく、筋量を直接に制御している
研究は、熊本大学発生医学研究所の藤巻慎助教、小野悠介准教授の研究グループが、同大学生命資源研究・支援センター、国際先端医学研究機構、生命科学研究部、長崎大学、京都府立大学、ミネソタ大学と共同で行ったもの。研究成果は、「Nature Metabolism」に掲載された。
サルコペニアは「筋力が劣り転倒骨折からの長期の入院生活(不活動) → 不活動によるフレイルの発症・進行 → 抜け出せない介護生活」という負のスパイラルの入り口となる。
サルコペニアやフレイルを解決し健康長寿社会を実現するためには、筋萎縮を抑え、生涯にわたり筋量を維持することが重要だが、筋萎縮を引き起こす上流のメカニズムについてはよく分かっていない。
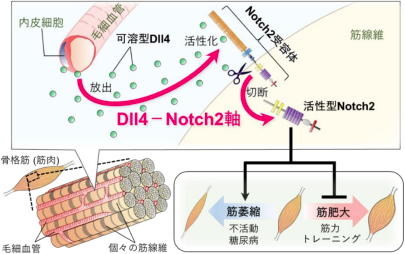
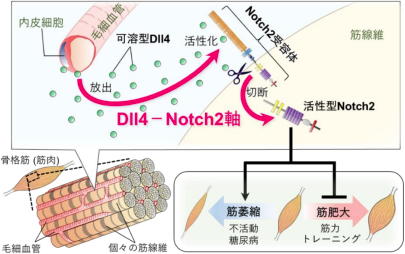
研究グループは今回の研究で、毛細血管は輸送媒体としての機能に加え、筋萎縮を引き起こすカギを握っていることを発見した。筋組織は、多くの筋線維の束で構成され、個々の筋線維間には毛細血管がくまなく分布し、酸素や栄養を供給している。
具体的な仕組みは、不活動あるいは糖尿病などの状態下では、毛細血管から「Dll4」が放出され、それが筋線維の「Notch2受容体」を活性化することで筋萎縮が誘導されるというもの。
Dll4は、Notch受容体を活性化する生理活性物質であるリガンドのひとつで、血管内皮細胞から放出される。Notch2受容体は、隣接した細胞間の接触シグナルに関与し、細胞の分化や増殖などを制御している。
研究グループは、この「Dll4-Notch2軸」の働きを減弱させると、不活動や糖尿病による筋萎縮を抑制できるのに加え、過負荷による筋肥大を促進することを明らかにした。
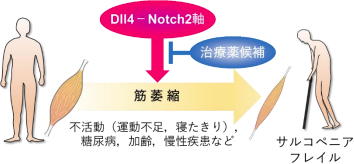
Dll4-Notch2軸は、筋萎縮を誘導するための重要な上流メカニズムとなり、サルコペニアやフレイルに対する有望な予防治療標的になると考えられる。
研究から、血管は末梢組織に酸素や栄養を運ぶ単なる輸送媒体ではなく、筋量を直接に制御するという、これまでまったく知られていなかった機能を有することが明らかになった。
「血管は全身の組織・臓器にくまなく分布することから、内皮細胞が放出するDll4は、筋萎縮の上流メカニズムに留まらず、さまざまな組織・臓器の疾患発症に広く関与している可能性もあります」と、研究グループでは述べている。
筋線維を活性化するDll4とその受容体が、不活動と糖尿病による筋萎縮の上流メカニズムに
「Notchシグナル」は、進化的によく保存された細胞間接触シグナルのひとつで、受容体の特定部位に結合し生理活性を担うリガンドを発現する細胞が、受容体を発現する細胞に接触することで活性化される。哺乳類ではNotch受容体は4種類(Notch1~4)、リガンドは5種類(Jag1、Jag2、Dll1、Dll3、Dll4)がある。
研究グループはこれまで、骨格筋の組織幹細胞であるサテライト細胞でのNotch2の機能解明に取り組んできた。サテライト細胞は、骨格筋の成長・肥大・再生に必須の役割を担う筋組織幹細胞。
その後、Notch2はサテライト細胞のみならず、分化成熟した筋線維にも発現していることが分かった。筋線維に発現するNotch2の機能を明らかにするために、筋線維特異的に活性型Notch2をマウスに強制発現させたところ、筋萎縮が認められた。
逆に、筋線維特異的にNotch2を欠損させたマウスを解析したところ、不活動や糖尿病にともなう筋萎縮が顕著に抑制されることを観察した。
次に、筋萎縮の上流メカニズムとして、筋線維のNotch2を活性化させるリガンドの同定に取り組んだ。5種類のNotchリガンド組換えタンパク質を培養皿にそれぞれ固相化し、マウス骨格筋から単離した単一筋線維をその上に撒いて、培養上でNotchリガンドと筋線維を接触させた。
その結果、Dll4と接触した筋線維のみがNotch2の活性化を介して萎縮を呈することが分かった。
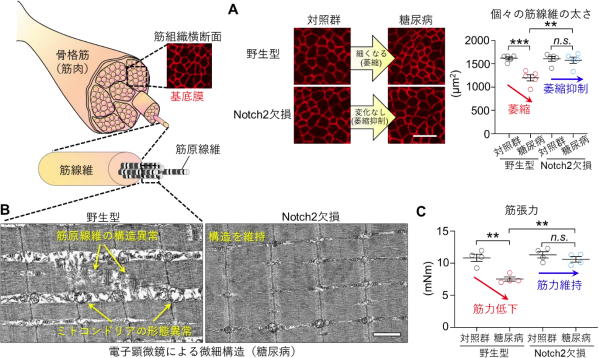
(B)糖尿病マウス筋組織の電子顕微鏡像
(C)前脛骨筋の筋張力:糖尿病により野生型マウスの筋張力は低下するがNotch2欠損マウスでは変化しない
先行研究では、筋組織内でDll4を発現する細胞種は、毛細血管を構成する内皮細胞のみであることが報告されている。研究グループはそれに加え、シングル核RNAシークエンス解析や免疫組織化学解析により、筋萎縮が生じる条件下では、内皮細胞のDll4発現レベルが増加することを確認した。
Notchシグナルでは、リガンドを発現する細胞と受容体を発現する細胞の細胞間接触が重要となる。しかし、電子顕微鏡下では内皮細胞と筋線維が直接的に接触する様子は観察されなかった。
そこで免疫電子顕微鏡解析によりDll4の局在を調べたところ、Dll4は内皮細胞と筋線維の間質に存在していることを見出した。この観察像から、筋萎縮が誘導される状況で、内皮細胞はDll4を放出することで、細胞間接触を介さずに遠隔から筋線維のNotch2を活性化させるのではないかと仮説を立てた。
この仮説を検証するために、マウスの初代培養内皮細胞と単一筋線維の非接触型共培養モデルを新たに確立した。そのモデルを用いて、内皮細胞はDll4を放出し、細胞間の接触なしに筋線維のNotch2を活性化させ、筋萎縮を誘導することを証明した。この機序は、ヒト培養細胞でも確認できた。
最後に、Dll4が筋萎縮の上流メカニズムとして創薬標的になりうるのかを検証するために、Dll4阻害による筋萎縮抑制効果をマウス個体レベルで評価した。
その結果、内皮細胞特異的にDll4を減少させた遺伝子改変マウス、Dll4阻害剤またはDll4中和抗体を投与したマウスは、不活動や糖尿病による筋萎縮を効果的に予防することが分かった。
興味深いことに、Dll4の阻害は筋萎縮を抑制するのみならず、筋力トレーニングを模倣した過負荷刺激モデルによる筋肥大を促進した。
以上から、Dll4は筋萎縮を促進し、筋肥大を抑制することから、Dll4の阻害は創薬標的として有望であることが示唆された。
「研究では、筋線維に発現するNotch2受容体が血管から放出されるDll4によって活性化されるDll4-Notch2軸を見出し、この軸が不活動と糖尿病という異なる要因により誘発される筋萎縮の共通した上流メカニズムになることを明らかにしました」と、研究グループでは述べている。
「筋萎縮に対する予防治療薬の開発で、Dll4-Notch2軸は魅力的な標的になると考えられます。たとえば、転倒骨折から入院したケースでは、Dll4-Notch2軸の働きを減弱させることで、寝たきりによる筋萎縮を予防し、リハビリ期間にも効果的な筋量の回復を望むことができるかもしれません」。
「とくに、糖尿病の場合は、より治療効果を享受できる可能性が高まります。サルコペニアやフレイルに対しても、Dll4-Notch2軸が創薬標的になりうるのか、今後検証していきます」としている。
熊本大学発生医学研究所筋発生再生分野
The endothelial Dll4−muscular Notch2 axis regulates skeletal muscle mass (nature metabolism 2022年2月28日)