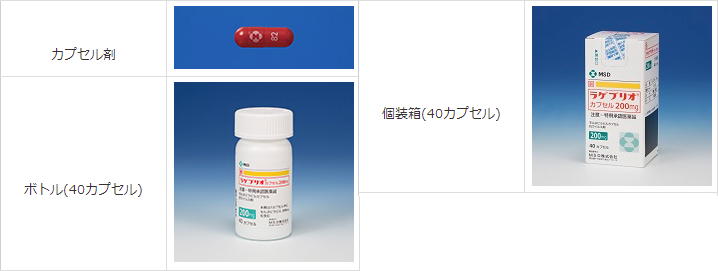
【新型コロナ】国内初の経口抗ウイルス薬「ラゲブリオ」 COVID-19治療薬として特例承認
COVID-19による入院または死亡が減少
初の経口抗ウイルス薬である「ラゲブリオ」の日本での承認申請は、重症化リスク因子を1つ以上有し、軽症から中等症*のCOVID-19の入院していない成人患者を対象として同剤を評価する第3相MOVe-OUT試験の中間解析の結果にもとづいて行われた。
同剤は、SARS-CoV-2の予防投与、治療、感染防止などのいくつかの非臨床モデルにおいて活性が認められている。非臨床試験では、同剤が耐性化しにくいことがデータで示されている。
同剤は、他の薬剤との併用や食事に関する制限、腎機能や肝機能障害における用量の変更の必要のない単剤療法として試験が実施されている。これまでに明らかになっているデータでは、同剤の薬物相互作用は特定されていない。
同剤はエモリー大学で発明され、同大学が設立したDrug Innovation Ventures at Emory (DRIVE)が開発を進め、臨床試験実施申請(IND)に至った。現在、開発はMerck & Co.とRidgeback Biotherapeuticsが共同で進めている。
「日本で承認された初の経口抗ウイルス薬のラゲブリオは対象となる患者さんのもっとも深刻な重症化や入院を防ぎ、医療機関や日本政府が新型コロナウイルス感染症の深刻な状況に対応するためのとても重要な新しい武器になると考えています」と、同社では述べている。

COVID-19の主流の変異株に対し一貫した効果
「ラゲブリオ」は、無作為化プラセボ対照二重盲検国際多施設共同第3相MOVe-OUT試験で、検査により陽性と判定され、重症化のリスク因子を1つ以上有する、入院していない、症状のある軽症から中等症のCOVID-19成人患者を対象として評価が行われた。試験結果は、「New England Journal of Medicine」に掲載された。
同試験のデータでは、重症化リスクの高い、ワクチン未接種のCOVID-19の成人患者に早い段階でラゲブリオを投与することで、入院または死亡のリスクが有意に低下することが示された。
同試験の第3相試験部分は、アルゼンチン、ブラジル、カナダ、チリ、コロンビア、エジプト、フランス、ドイツ、グアテマラ、イスラエル、イタリア、メキシコ、フィリピン、ポーランド、ロシア、南アフリカ、スペイン、スウェーデン、台湾、ウクライナ、英国、米国など世界各国の170以上の施設で実施された。
同剤は、曝露後の発症予防として、家庭内での新型コロナウイルスの拡大を防止する効果と安全性を評価する二重盲検無作為化プラセボ対照国際多施設共同第3相試験のMOVe-AHEADも実施されている。
MOVe-OUT試験の主要有効性評価項目では、29日目までに入院または死亡に至った患者の割合をラゲブリオ(800mg、1日2回、5日間)とプラセボで比較した。
同試験の対象患者は、重症化のリスク因子(61歳以上、活動性がん、慢性腎臓病、慢性閉塞性肺疾患、肥満、重篤な心疾患、糖尿病)を1つ以上有し、治験登録前の5日以内に発症した患者だった。
主な除外基準は、48時間以内にCOVID-19による入院が必要となることが予想される、現在透析中またはeGFRが30mL/min/1.73m²未満、投与中および治験薬の最終投与後4日以上にわたり避妊薬を使用することを望まない、重篤な好中球減少症(好中球絶対数が500/mL未満)、血小板数が100,000/ul未満、SARS-CoV-2ワクチンの接種歴、妊娠などだった。
ラゲブリオを妊娠時に服用した場合の胎児発育への影響は明らかになっていない。解熱薬、抗炎症薬、糖質コルチコイドやその組み合わせによる標準療法は許容された。COVID-19の治療を目的とする薬剤(モノクローナル抗体やレムデシビルを含む)は、29日目まで投与が禁じられた。
無作為化された全被験者の解析では、47.7%の患者で無作為割り付け前の3日以内に兆候または症状が認められ、44.5%が中等症のCOVID-19だった。リスク因子で多かったのは肥満(73.7%)、61歳以上(17.2%)、糖尿病(15.9%)だった。
ベースライン時にSARS-CoV-2抗体陽性であり、最近または以前に感染(ワクチン接種ではない)したことが示唆される患者は19.8%だった。解析は現在も継続中であり、掲載時点でベースライン時のウイルス変異型が判明していなかった患者は中間解析では25.9%、無作為化された全被験者では44.7%だった。無作為化された全被験者のうちシーケンスデータが得られていた被験者(55.3%)で最多のSARS-CoV-2変異株は、デルタ株(58.1%)、ミュー株(20.5%)、ガンマ株(10.7%)だった。
中間解析(この試験の主たる解析)の時点で、同剤の投与による優越性が認められ、入院または死亡が減少した。ラゲブリオ群では入院した患者は7.3%(385例中28例)、プラセボ群では入院または死亡した患者は14.1%(377例中53例)だった。中間解析の時点でラゲブリオ群では29日目までの死亡例はなく、プラセボ群では8例だった。
ラゲブリオ群とプラセボ群における29日目までの入院または死亡の絶対リスク減少率は6.8%(95% CI: 2.4, 11.3; p=0.001、片側)で、相対リスク減少率は約50%だった。無作為化された全被験者の解析(1,433例)で、29日目までの入院または死亡のリスクはプラセボ群の9.7%(699例中68例)に対しラゲブリオ群では6.8%(709例中48例)に低下し、絶対リスク減少率は3.0%(95% CI: 0.1, 5.9)、相対リスク減少率は30%となった。
同剤の効果のベネフィットは、懸念されるSARS-CoV-2変異株、デルタ株、ガンマ株、ミュー株の感染者など、全ての重要な患者サブグループでおおむね一貫していた。死亡例はプラセボ群では9例(29日のすべての死因による死亡率は1.3%)、ラゲブリオ群では1例(29日のすべての死因による死亡率は0.1%)報告され、死亡リスクの相対減少率は89%(95% CI: 14, 99)だった。
これまでの治験と同様に、同剤の安全性の懸念は特定されず、臨床検査の結果でも臨床的に意味のある異常を示す所見はなかった。有害事象(AE)の発現率はラゲブリオ群とプラセボ群で類似しており、(それぞれ30.4%、33.0%)。治療関連有害事象の発現率も同様に類似していた(それぞれ8.0%、8.4%)。
有害事象により治療を中止した患者はラゲブリオ群ではプラセボ群より少なくなった(それぞれ1.4%、2.9%)。重篤な有害事象はいずれも治験責任医師により治験薬との因果関係がないと判断され、ラゲブリオ群の方が発現率は低くなった。29日目までにラゲブリオ群では1名の患者が死亡し、プラセボ群では9名の患者が死亡した。29日経過後、有害事象によりさらにプラセボ群では3名、ラゲブリオ群では1名死亡した。
「ラゲブリオは、治験実施時点で主流となっている変異株に対し一貫した効果が認められており、さらに最近の非臨床の所見では、オミクロン株に対する抗ウイルス活性が認められ、SARS-CoV-2のような変化の速いウイルスによる先の見えない状況において非常に心強いことです」と、同社では述べている。
ラゲブリオカプセル200mg 添付文書/患者向医薬品ガイド/同意説明文書 (医薬品医療機器総合機構)