糖尿病の「再生医療・幹細胞治療」を自由診療で提供 安全性・有効性に疑問 構造的課題を指摘
幹細胞治療が高額で患者に提供されている現状を問題視
研究は、京都大学高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)の藤田みさお特定教授(兼:京都大学iPS細胞研究所特定教授)らの研究グループによるもの。研究成果は、「Cell Stem Cell」に掲載された。
安全性や有効性が証明されていない、つまり科学的エビデンスがない、幹細胞治療が高額で患者に提供され、世界中で問題視されている。合併症または死亡といった有害事象や、患者・家族による訴訟も報告されている。
研究グループが分析した結果、2,377医療機関による3,467件の(幹)細胞治療の提供が可能となっている。なかには、ISSCR(国際幹細胞学会)のガイドラインが非難する治療(たとえば、培養した(幹)細胞を患者に投与する治療など)の他、科学的エビデンスが確立していないがん免疫療法が多数含まれていた。
再生医療法下でどのような(幹)細胞治療の提供可能かを調査
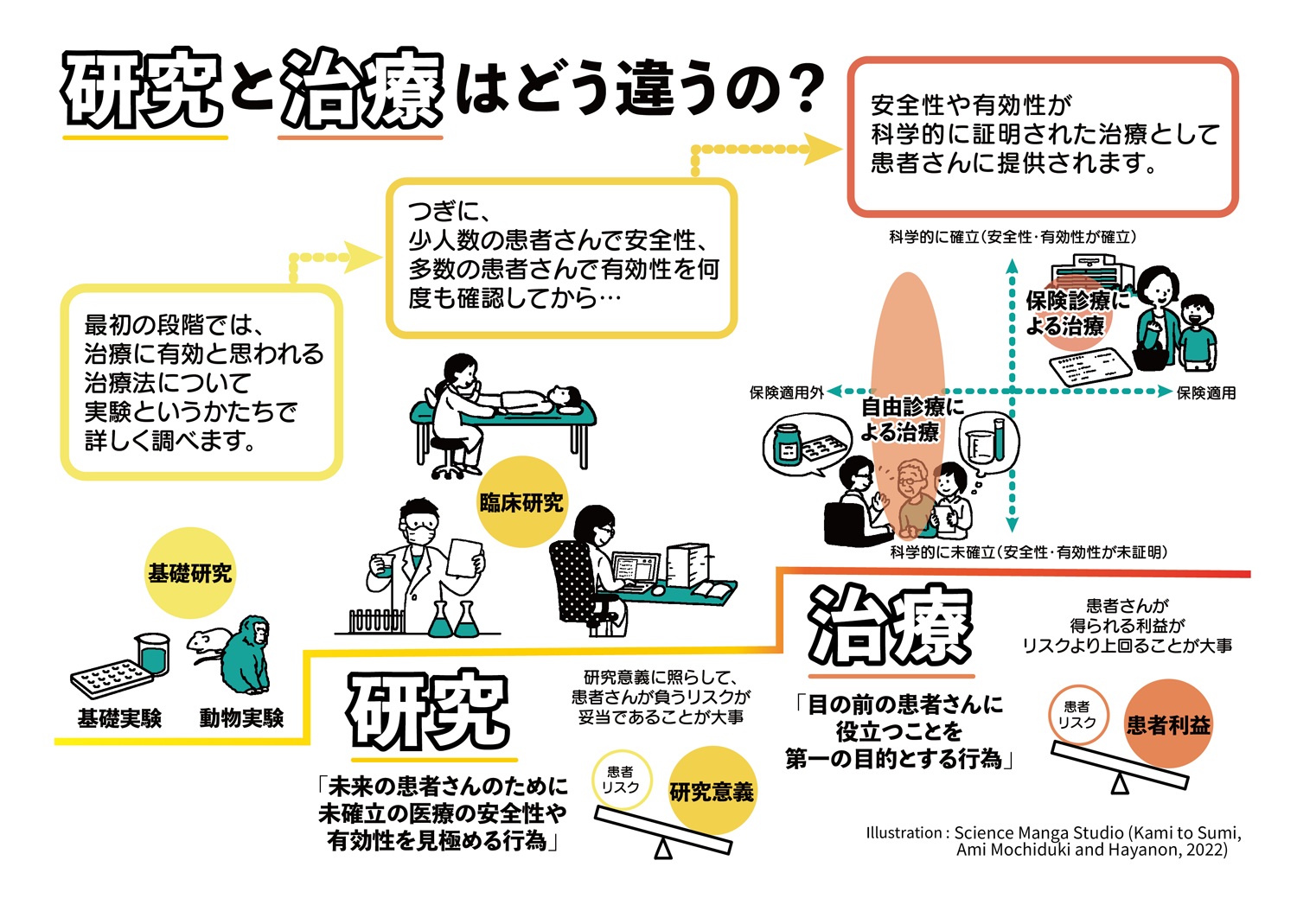
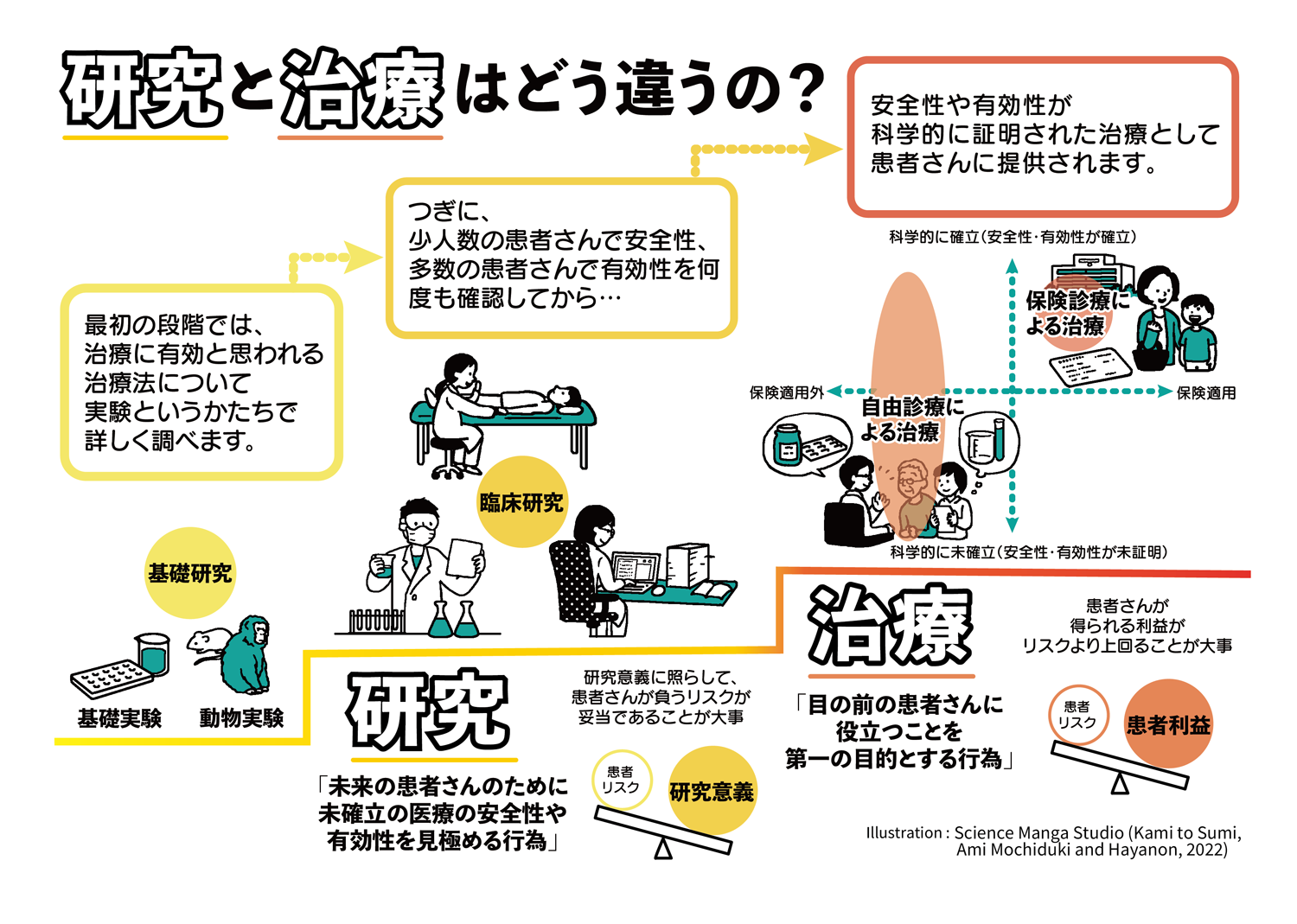
研究グループは、「本来は"治療"は、"研究"を通じて安全性や有効性が証明されてはじめて患者に提供される医療です」と強調している。
しかし、日本では自由診療という枠組みで医師と患者の合意があれば、安全性や有効性の証明が十分でない治療でも提供が可能であり、その実態も十分に把握されていない。
2014年に制定された日本の「再生医療等安全性確保法(再生医療法)」は、自由診療でも細胞を治療として人に投与する場合は、専門委員会による提供計画の承認や、厚生労働省への提出など、一定の条件を設けている。しかし、「なかには安全性や有効性が定かではない治療が含まれている可能性があります」としている
2017年に、再生医療法の一部が改正され、「再生医療等を受ける者に対する説明文書及び同意文書」を厚生労働省のウェブサイトに開示することが義務づけられた。
そこで研究グループは今回、この文書をもとに、再生医療法下で現在、どのような(幹)細胞治療の提供が可能となっているのか、日本の現状を正確に把握し、問題点を明らかにすることを目指した。
研究で安全と有効性を科学的に証明してはじめて治療として提供できる
研究グループでは、次のように述べている。
今後の再生医療法の改正においては、上記の3つの基本的概念を明確にし、医療機関、医師及び特定/認定再生医療等委員会といった関係者の間で確実に共有できる内容または運用を実現することが望まれるとしている。
「本研究の意義は、安全性や有効性が疑わしい(幹)細胞治療を法律で禁じていない、非英語圏の日本における実態を報告した点にあります。これまでに海外で行われた実態調査は、ほとんどがそうした治療を法律で禁じている国や、英語圏からの報告だったからです」と、研究グループは述べている。
「本研究の成果が周知されることによって、海外で問題視されている(幹)細胞治療が日本でも課題として広く認知されること、研究によって安全で効くと科学的に証明されて初めて治療として提供されるという基本的な考え方が浸透すること、合法だから安全で有効と誤解したまま治療を受ける患者が減ることが望まれます。また、専門分野ごとに再生医療の科学的エビデンスが整理されることも期待されます」としている。
研究グループは今後、一般市民を対象としたアンケート調査を通して、再生医療に対する認識や誤解について明らかにしたいと考えだ。また、研究と治療の区別が曖昧で誤解されやすい医療と法規制の課題についてさらに検討を進めたいとしている。
京都大学高等研究院ヒト生物学高等研究拠点 (WPI-ASHBi)
Current Status of Cell-based Interventions in Japan (Cell Stem Cell 2022年9月1日)











