⻭周病が⾮アルコール性脂肪性肝疾患(NAFLD)を悪化させる ⻭周病菌が腸内細菌叢に悪影響

⻭周病は全⾝疾患のリスク因⼦ NAFLDも悪化させる
⾮アルコール性脂肪性肝疾患(NAFLD)は、顕著なアルコール摂取がないにもかかわらず、肝臓に脂肪蓄積を認める疾患。NAFLDは、脂肪蓄積はあってもほとんど進⾏せず、予後が良好な⾮アルコール性脂肪肝と、脂肪変性に加えて炎症・線維化が顕著で、肝硬変や肝臓がんに進⾏するリスクが⾼い⾮アルコール性脂肪肝炎の2種類に分類される。
後者は肝臓関連死が有意に⾼く、⼼疾患によって死亡する可能性も⾼くなることが報告されている。NAFLDの患者数は増加の⼀途をたどり、日本でも1,000万⼈を超えると推定されている。
NAFLD病態を誘発するものとして、肥満や2型糖尿病、メタボなどに加えて、⻭周病もリスク因⼦であることが知られており、腸内細菌叢の関与が注⽬されている。
腸管は⾷事中の栄養素を消化・吸収し、⾨脈を介して肝臓に直接供給するが、腸内細菌・菌体成分や腸内細菌代謝物も肝臓に運ばれる。それらが肝臓で炎症を誘導したり、遺伝⼦発現に影響を与えたりすることが明らかになっている。
一方、⻭周病はさまざまな全⾝疾患のリスク因⼦であることが疫学研究によって明らかにされているが、多くの場合、因果関係を説明するメカニズムは解明されていない。
⻭周病菌が腸内細菌の機能や代謝物を変化させる
腸管バリア機能を低下し、内毒素⾎症を誘発
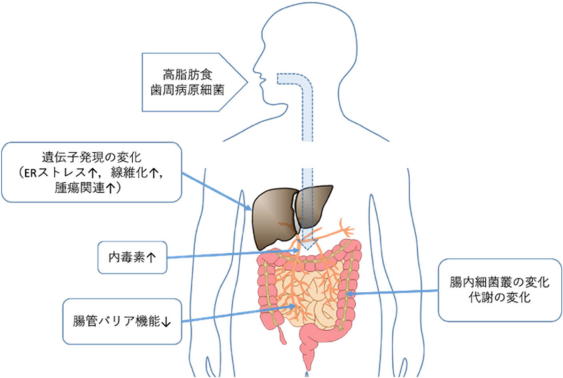
唾液とともに⼝腔細菌を飲み込まれるが、⻭周病患者の唾液中には多くの⻭周病原細菌が含まれている。研究グループはこれまで、⼝腔細菌、とくに⻭周病原細菌が腸内細菌叢や腸管バリア機能、腸内細菌代謝物を変化させることを報告してきた。
こうした変化は、NAFLDの病態発現と深く関わる現象であり、⻭周病とNAFLDの関連には、飲み込まれた⻭周病原細菌による腸内細菌叢への影響が関与しているのではないかと考えた。
そこで、普通⾷を与えて飼育したマウス⼝腔に、1週間に5回、1回あたり1x109の各種⼝腔細菌を投与する実験を行った。対照群には普通⾷を与え、実験群ではNAFLDを発症しやすい餌(⾼脂肪⾷:CDAHFD60)に変更し、さらに2週間細菌の投与を継続した。
細菌投与開始前、開始1週後、細菌投与を継続しながら餌を変更して2週後にそれぞれ糞便を採取して腸内細菌叢をメタゲノム解析するとともに、実験終了時に⾎液や肝臓、腸管組織を採取してNAFLDの病態や病因を解析した。
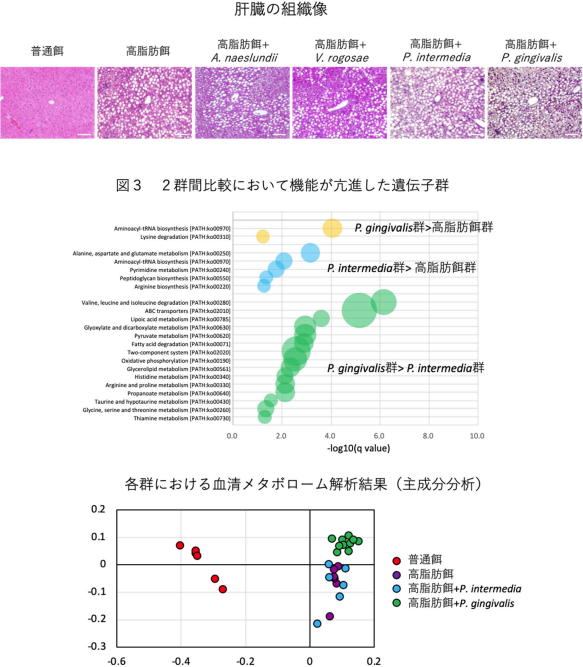
その結果、健康な⼝腔に関連する細菌(Actinomyces naeslundiiおよびVeillonella rogosae)については、菌を投与しない場合と同等であったのに比べ、⻭周病と関連する細菌(Prevotella intermediaおよびPorphyromonas gingivalis)を投与した場合は、NAFLDが有意に重症化していた。
また、⻭周病原細菌のなかでも病原性の強い細菌(P. gingivalis)は、それよりも病原性の弱い細菌(P. intermedia)に比べ、より重症化させた。
メタゲノム解析の結果、⻭周病原細菌の投与により、腸内細菌叢で芳⾹族アミノ酸合成に関わる遺伝⼦群の発現が⾼まること、⾼脂肪⾷を与えた環境では、P. gingivalis投与群でP. intermedia投与群に比べ、分岐鎖アミノ酸合成系の遺伝⼦発現が上昇することが明らかになった。
腸管バリア機能低下とそれにともなう内毒素⾎症の程度は、P. gingivalis投与群で有意に亢進し、⾎清代謝物のプロフィールも、P. gingivalis投与群で対照群、P. intermedia群とは明らかに異なり、芳⾹族アミノ酸や糖リン酸のレベルの上昇が認められた。芳⾹族アミノ酸や分岐鎖アミノ酸の上昇は、⼼⾎管疾患や糖尿病の予測因⼦になることが報告されている。
肝臓での網羅的遺伝⼦発現解析の結果は、P. intermedia投与群とP. gingivalis投与群で明らかな発現パターンの違いが示された。とくにP. gingivalisの投与により、NAFLD発症・進⾏に関与する⼩胞体ストレス、サーカディアンリズム、線維化、腫瘍化に関与する遺伝⼦発現に影響を与えることが⽰された。
⻭周病菌による腸内細菌への影響を阻害する善玉菌の発⾒に期待
以上の結果から、唾液とともに飲み込まれた⻭周病原細菌は、腸内細菌の構成と機能を変化させるとともに、腸管透過性を亢進させることで、肝臓の機能に悪影響を与え、NAFLDの発症・進⾏に関わることが明らかになった。
「⻭周病原細菌により影響を受ける腸内細菌を同定することで、原因となる細菌(群)を同定するとともに、健康な⼝腔細菌のなかで⻭周病原細菌による腸内細菌への影響を阻害する性質をもつ細菌の発⾒が待たれます」と、研究グループでは述べている。
「それらを基盤として細菌叢をターゲットにした⽣物学的治療法の開発により、従来の⻭周病治療における再発リスクを低減できる可能性が⾼まることに加えて、腸内細菌への介⼊効果により全⾝の健康維持にも貢献できると考えます」としている。
研究は、新潟⼤学⼤学院医⻭学総合研究科⻭周診断・再建学分野の⼭崎恭⼦研究員、同研究科⼝腔保健学分野(研究開始時)の⼭崎和久教授と理化学研究所⽣命医科学研究センター粘膜システム研究チームの⼤野博司チームリーダーらの研究グループによるもの。研究成果は、国際免疫学会連合のオンラインジャーナル「Frontiers in Immunology」に掲載された。
新潟⼤学⼤学院医⻭学総合研究科 ⻭周診断・再建学分野
理化学研究所⽣命医科学研究センター 粘膜システム研究チーム
Oral Pathobiont-Induced Changes in Gut Microbiota Aggravate the Pathology of Nonalcoholic Fatty Liver Disease in Mice(Frontiers in Immunology 2021年10⽉11⽇)











