DPP-4阻害薬「ジャヌビア錠」が製法変更 NTTP量を1日許容摂取量以下に管理 NTTPに発がんリスク
NTTP量を1日許容摂取量以下に管理するために製法変更 有効期間も変更
MSDは、シタグリプチンを含有するDPP-4阻害薬「ジャヌビア錠」および配合薬「スージャヌ配合錠」について、ニトロソアミン類であるNTTPが確認されたのを受け、2024年2月に、「ジャヌビア錠」でNTTP量を1日許容摂取量以下に管理するための製法変更(添加剤として「没食子酸プロピル」を追加)の製造販売承認事項一部変更承認を取得し、その製法変更にもとづき製造した製品の供給の目途が立ったと公表した。
同社は昨年9月に、「シタグリプチン製品におけるNTTPの検出及び発がんリスクに関する評価報告書」を公表し、NTTP量を1日許容摂取量(37ng/日)以下に抑えるために製造プロセス管理を強化していくことを公表していた。
なお、「スージャヌ配合錠」については、1日許容摂取量を上回るNTTP量を含む製剤は現時点で確認されていないことから、製法変更をすることなく、今後もこれまでの製法で製造した製品の供給を継続するとしている。
対象製品 (いずれも2024年2月時点)
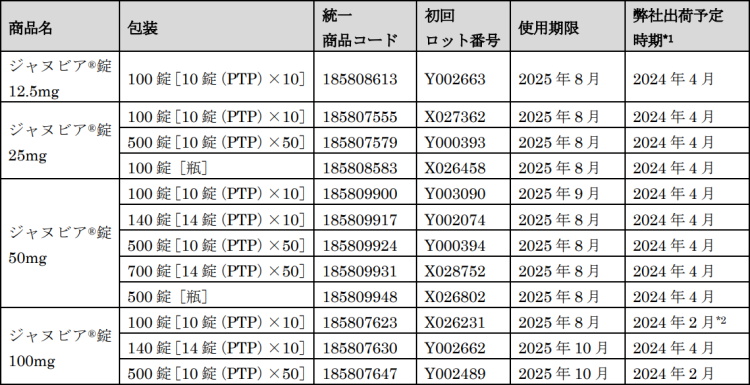
*2:既に同社から出荷開始済み。
有効期間の変更 (3年から2年への変更)
「先生方におかれましては、管理上、お手数をおかけすることになり申し訳ございませんが、ご理解賜りますようお願い申し上げます。なお、この有効期間の変更によりロット番号の逆転が生じることはございません」と、同社では述べている。
ジャヌビア(一般名:シタグリプチンリン酸塩水和物) (MSD Connect)
DPP-4阻害薬から発がん性の可能性があるNTTPを検出
厚生労働省医薬安全対策課などは昨年9月に、DPP-4阻害薬の「ジャヌビア」「グラクティブ」および配合薬の「スージャヌ」について(いずれも一般名はシタグリプチンリン酸塩水和物およびその配合薬)、発がん性を有する可能性のあるニトロソアミン類(NTTP)が検出された問題をめぐり、安全性評価を報告している。
ラットを用いてNTTPの遺伝毒性を評価する試験を行った結果、NTTPを経口投与されたラットの肝臓で遺伝毒性が認められたことから、NTTPは発がんリスクが示唆されるとしている。
ただし一般的に、ニトロソアミン類は発がん性を有する可能性があるが、NTTPが発がん性を有するかは不明としている。
シタグリプチン単剤については、製法変更などにより、製剤中のNTTPを低減する方針で検討が進められ、国内に流通するすべての製剤が、NTTPを低減した製剤に入れ替わると見込まれる時期は2027年2月としていた。
それまでに、同剤100mgを毎日服用した場合の理論上の発がんリスクの上昇の程度は、NTTPの1日許容摂取量を37ngとした場合は、生涯で11万5,000人に1人あるいは31万2,000人に1人が、過剰にがんを発症する程度のリスクに相当するとしている。
なお、日本で同剤が承認を受けた2009年10月から2023年8月31日までに、同剤のがんに関連する国内副作用症例報告は105件報告されているが、いずれも因果関係は明確ではない。厚労省調査会では「患者自身の判断のみにより服用を中止しないことを説明してほしい」などとしていた。
関連情報











