糖尿病治療薬のメトホルミンと抗がん剤の併用療法の有効性を評価 医師主導で第2相試験を開始
メトホルミンをがんの治療薬として使える可能性
メトホルミンの発がん抑制作用についてはさまざまな研究が行われ、同剤に発がん抑制作用があることが、後ろ向き研究で報告されている。4件のコホート研究と2件のランダム化比較試験の計6研究を解析した研究では、メトホルミンはがんによる死亡リスクを34%減少させることが報告されている。メトホルミンががんの治療薬として使えることが示唆され、さまざまながんに対する臨床試験が進行中だ。
そこで国立がん研究センターは、初発膠芽腫に対し、標準治療に糖尿病治療薬メトホルミンを併用した場合の安全性・有効性を評価する第2相臨床試験を開始することを発表した。同試験は、同センター、山形大学など5施設で、先進医療Bとして実施される。
膠芽腫は、手術後に放射線治療と薬物療法(テモゾロミド)を行うのが標準治療だが、治療開始からの5年生存割合は15%程度の難治がんで、急速に言葉の障害や手足の麻痺が進む悪性脳腫瘍だ。年間発生数は2,200人程度(2016年全国がん登録データ)の希少ながんでもあり、新規治療の開発が進んでおらず、有効な治療開発が望まれている。
膠芽腫の治療成績を改善するためには、治療後の再発を抑制することが重要で、そのためには再発の要因となる「がん幹細胞」を標的とする治療法の開発がひとつの鍵となると考えられる。
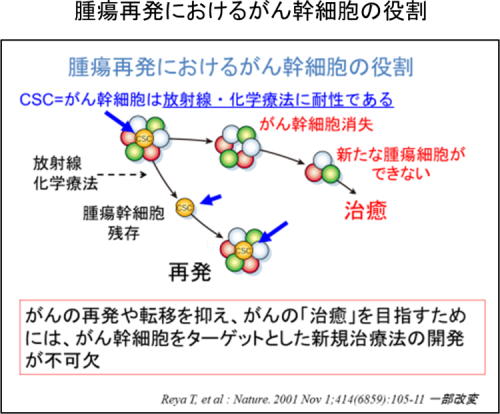
メトホルミンが膠芽腫のがん幹細胞の腫瘍形成能を喪失
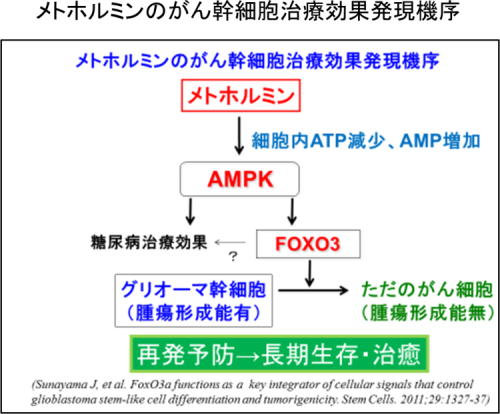
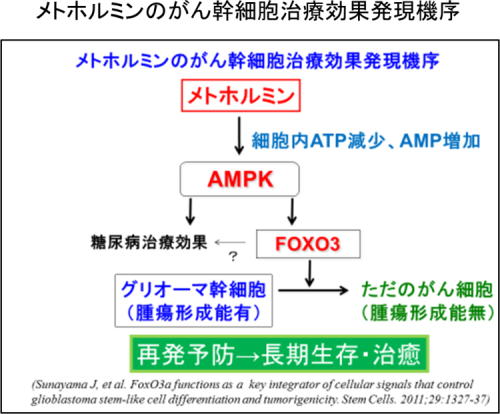
山形大学医学部腫瘍分子医科学講座の北中千史教授と国立がん研究センター中央病院の研究グループはこれまで、一連の研究からがん幹細胞中のFOXO3という分子を活性化することができれば、がん幹細胞を再発不可能な「ただのがん細胞」に変化させられることを確認している。さらに、メトホルミンがFOXO3活性化能を持つことに着目した研究を進めてきた。
その結果、培養状態の膠芽腫幹細胞にメトホルミンを作用させると、がん幹細胞としての性質が消失する可能性が示唆された。また膠芽腫モデルマウスにメトホルミンを投与したところ腫瘍中のがん幹細胞が減少することを確認し、メトホルミンが膠芽腫のがん幹細胞の腫瘍形成能を喪失させる可能性が示唆された。
研究グループは、これらの研究成果をもとに、膠芽腫の患者に対してメトホルミンの有効性を評価する臨床試験の実施を模索してきた。しかし、メトホルミンの薬価が1日投与分(2,250mg)でも90.9円で、1年投与しても3万3,178円と安価であること、さらにメトホルミンは後発品が多数あり、抗がん剤としての開発には多額の経費が必要であることから、企業の協力が得られなかった。
このように、製薬企業主導では臨床開発を進めにくいことから、医師主導で臨床試験を計画し、2020年度AMEDの革新的がん医療実用化研究事業として「がん幹細胞を標的とした初発膠芽腫の放射線+テモゾロミド+メトホルミン併用療法の第1・2相臨床試験(研究代表者:成田善孝)」が採択された。
P1試験でメトホルミン2,250mg+テモゾロミド併用で問題ないこと確認
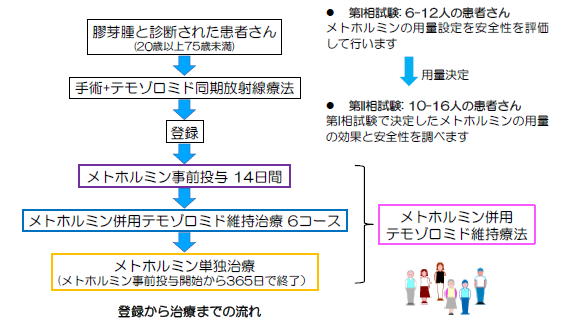
第2相臨床試験では、20~75歳の外来通院可能な初発膠芽腫患者を対象に、標準治療である手術後の放射線治療とテモゾロミドにメトホルミンを併用する。
「メトホルミン経口投与及びテモゾロミド経口投与の併用療法」として先進医療Bでの実施が2021年2月に許可され、3月から第1相臨床試験を、同センター中央病院脳脊髄腫瘍科などで実施。2022年3月までに、7人の初発膠芽腫の患者に標準治療薬であるテモゾロミドとメトホルミン1,500mg(4人)および2,250mg(3人)を投与し安全性を評価する第1相試験を行った。併用時に重篤な有害事象は見られず、メトホルミンの最大用量である2,250mgとテモゾロミドを併用しても問題ないことがわかった。
その後、先進医療技術審査部会で審議され、2022年6月から有効性を評価する第2相臨床試験を国立がん研究センター中央病院など5施設で開始した。第2相臨床試験では15人の患者の参加を予定している。
P2試験は15人を登録予定、標準治療に対する優位性などを評価
第2相試験は、手術による腫瘍摘出後、メトホルミン500mgを7日間事前内服し、テモゾロミドとの併用でメトホルミン2,250mgを内服する。これを事前内服含め2回繰り返し観察を行い、安全性(用量制限毒性)を評価する。
テモゾロミドとメトホルミンの併用は6回まで行い、その後メトホルミンを約6ヵ月間(メトホルミン投与から1年間)内服する。主要評価項目は用量制限毒性発現割合、プロトコール完遂割合。副次評価項目は有害事象発現割合、プロトコール治療完遂割合、6・12ヵ月の無増悪生存割合、全生存期間、奏効割合。
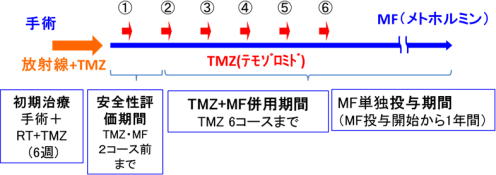
主な研究仮説は「試験治療(RT)+TMZ+MF(メトホルミン)療法)の無増悪生存期間が標準治療(RT+TMZ単独)に対して有意に上回る」としれた。標準治療の【RT+TMZ, TMZ維持療法6コース】の12ヵ月の無増悪生存割合が27%と報告されていることから、RT+TMZ+MFの12ヵ月の無増悪生存割合が50%を上回れば、RT+TMZ+MFが有望と判断して第3相試験(RT+TMZ vs. RT+TMZ+MF)が計画される。
RT+TMZ開始からの12ヵ月の無増悪生存割合を50%と仮定すると、有意水準片側10%、検出力70%とし、登録期間2年・フォローアップ期間1年として、二項分布に基づく正確な方法を用いて必要解析対象数を計算すると、必要な症例数が20例となる。若干の不適格例や追跡不能例を見込み、第1相、第2相合計で予定登録数は22例とした。
「メトホルミンの発がん抑制作用についてはさまざまな研究がなされ、メトホルミンに発がん抑制作用があることが、後ろ向き研究で報告されています。膠芽腫に対するメトホルミンの有用性が明らかとなれば、患者さんにとって新たな治療法の選択肢となり、また医療費も安く抑えられます」と、研究グループでは述べている。
国立がん研究センター中央病院
日本医療研究開発機構(AMED)ゲノム・データ基盤事業部
jRCT 臨床研究実施計画・研究概要公開システム jRCTs031200326











