アミノ酸バランスの乱れた食事が脂肪肝を悪化させる 遊離アミノ酸代謝や酸化ストレス応答機構がNAFLDの新たなターゲットに
遊離アミノ酸代謝や、酸化ストレス回避するための防御機構である酸化ストレス応答が、非アルコール性脂肪性肝疾患(NAFLD)の新たな治療ターゲットとなることが期待される。

脂肪肝に関与する遊離アミノ酸不均衡と酸化ストレス応答の関係を解明
非アルコール性脂肪性肝疾患(NAFLD)は、アルコールを多量に摂取していないにも関わらず、過栄養のために脂肪肝を生じる慢性肝疾患。肥満人口の増加にともない全世界的に急増しており、日本の成人の有病率も約30%程度とされている。
NAFLDの一部は肝硬変・肝がん発症の原因となるので、病態の解明と治療薬の開発が急務となっているが、現時点で有効な治療方法は、食事・運動療法による減量や一部の糖尿病薬の副次効果に限られており、有効な治療薬はいまだない。
近年、腸内細菌叢の研究の進歩とともに、NAFLD患者では腸内細菌叢の構成が異なっており、腸内細菌の代謝産物などによる代謝調節機構が肥満関連のさまざまな病態に関与していることが報告されている。
腸内細菌によって産生された代謝産物は門脈を経由し肝臓に流入することから、門脈血中の代謝産物の解析はNAFLDの病態を解明するために重要と考えられる。
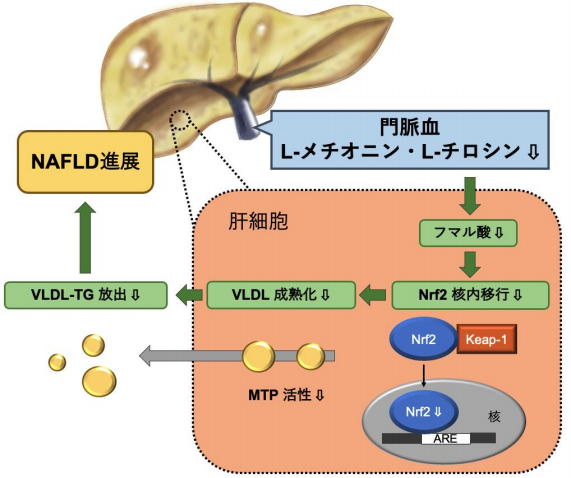
そこで研究グループは、腸から肝臓に流入する門脈血内の遊離アミノ酸と脂肪肝の関係について解析し、脂肪肝モデルマウスでは空腹時門脈血中の遊離アミノ酸のバランスが乱れており、2つのアミノ酸(メチオニンおよびチロシン)の低下が脂肪毒性に対する酸化ストレス応答を妨げ肝細胞からの脂質放出を抑制することを明らかにした。
酸化ストレスはさまざまな病気の原因となるが、酸化ストレス応答はこの変化を回避するための防御機構として働いている。
研究は、東北大学大学院医学系研究科消化器病態学分野の佐野晃俊氏、嘉数英二助教、正宗淳教授らの研究グループによるもの。研究成果は、「HEPATOLOGYに掲載された。
メチオニン・チロシンの低下により、肝細胞からの脂質放出が抑制
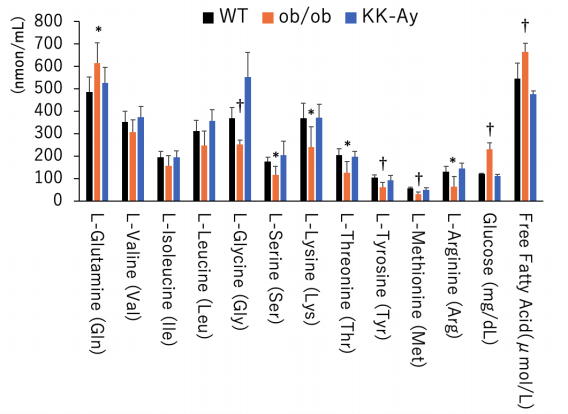
研究グループは、脂肪肝の動物モデル(ob/obマウス)の門脈血中のアミノ酸濃度を測定し、過栄養状態にも関わらず7種類の遊離アミノ酸が低下していることを発見した。
アミノ酸低下の影響を培養した肝細胞を使用した実験で確認した結果、7種類の遊離アミノ酸のうちメチオニンおよびチロシンレベルの低下により、肝細胞からの脂質の放出が抑制されていることが分かった。
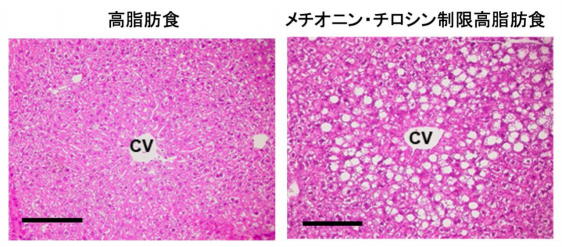
また、健常な野生型のマウスにメチオニンおよびチロシンを制限した高脂肪食を与えることで、NAFLDの病態を再現することができた。
細胞内でメチオニンおよびチロシンが代謝されると、フマル酸が産生される。フマル酸は酸化ストレス応答タンパク質であるNrf2の核内移行を促進することが知られている。
高脂肪の食事では、脂肪酸によって肝細胞内のフマル酸濃度が上昇し、Nrf2の核移行が促進するが、高脂肪かつ低メチオニン・チロシンの食事では肝細胞のフマル酸濃度の上昇が起きなかった。
また細胞実験で、フマル酸の前駆体を添加することで、肝細胞内の脂質の貯留が改善されることを確認した。
Nrf2を肝臓で活性化すると脂肪肝が軽減される
次に、Nrf2の働きが肝臓で活性化されている遺伝子改変マウス(Nrf2を抑制する働きをもつKeap1遺伝子を肝臓特異的に抑制したマウス:Keap1変異マウス)を用い検討した。
通常マウスでは高脂肪かつメチオニン・チロシン制限食によりNAFLDの病態が再現されるが、このKeap1変異マウスでは脂肪肝の変化が軽減されていた。
またKeap1変異マウスの肝臓からオルガノイドを作成し、脂肪の蓄積を解析したところ、メチオニン・チロシン制限環境下での脂質の蓄積が抑制された。オルガノイドは、試験管内で創出される、生体臓器に類似した構造や機能を有する三次元組織。
さらに、NAFLD患者で、末梢血中遊離脂肪酸とメチオニン・チロシンの割合が肝脂肪化レベルに相関関係があることも見出した。
「研究結果から、脂肪肝モデルマウスでは門脈血中の遊離アミノ酸のバランスが崩れており、このうちメチオニン・チロシンの低下はフマル酸代謝・酸化ストレス応答を経て肝細胞で脂質の蓄積を誘導することが明らかになりました。今回の研究から、遊離アミノ酸代謝・フマル酸代謝がNAFLDの新規治療ターゲットとなることが期待されます」と、研究者は述べている。
東北大学大学院医学系研究科消化器病態学分野
Steatotic hepatocytes release mature VLDL via methionine and tyrosine metabolism in a Keap1-Nrf2 dependent manner(HEPATOLOGY 2021年3月16日)