腸内細菌を標的としたNAFLD/NASH治療法を開発 腸内細菌由来の酢酸が肝臓のインスリン抵抗性を改善
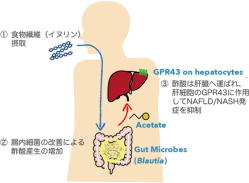
イヌリンの摂取がNAFLDやNASHの発症を抑制
非アルコール性脂肪性肝疾患(NAFLD)は、肝臓への脂肪の蓄積や肝肥大を特徴とする生活習慣病であり、肥満や2型糖尿病などの代謝症候群とも深く関連している。NAFLD患者の1/4程度はさらに深刻な肝疾患である非アルコール性脂肪性肝炎(NASH)を発症し、その1~2割が肝硬変の発症に至り、さらには肝がんへと進行する。アメリカや東アジアでNAFLDの罹患率は25%以上とされており、世界的な健康問題のひとつとなっている。
NAFLD/NASHの病態形成に、腸内細菌の異常が関わっている可能性が示唆されている。そのため、腸内細菌は重要な治療標的のひとつといえるが、その具体的な方法については解明されていない。
そこで研究グループは、マウスに高脂肪/高フルクトース/高コレステロール食を20週間与えてNAFLD/NASHを誘導した病態モデルで、プレバイオティクスであるイヌリンの効果を調べた。イヌリンなどの水溶性食物繊維には、宿主に有益な腸内細菌を増殖させる作用がある。
その結果、イヌリン摂取群では対照群と比べて肝肥大の抑制、血中ALT低下といったNAFLD/NASHの抑制効果が確認された。さらに、腸内細菌叢を解析した結果、イヌリン投与群では、酢酸生産菌であるBlautia productaやBacteroides acidifaciensが増加しており、実際に腸管内および門脈血中の酢酸濃度が顕著に上昇した。
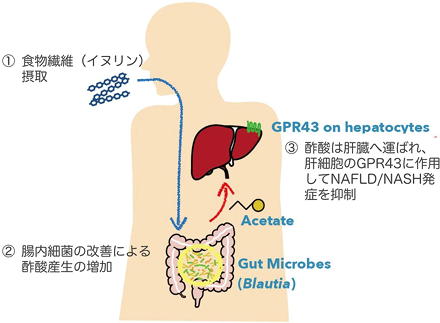
イヌリンが腸内細菌によって分解され酢酸が産生
酢酸は肝細胞のGPR43を介してインスリン抵抗性を改善
酢酸化レジスタントスターチをマウスに与えて、腸管内の酢酸濃度を高めた。酢酸化レジスタントスターチは、ヒトの消化酵素では分解できない難消化性デンプンに酢酸を共有結合した機能性食品。
その結果、NAFLD/NASHの発症が抑制され、腸内で産生された酢酸が肝臓に取り込まれることで病態を抑制していることが確認された。
酢酸の受容体としてFFAR2(GPR43)とFFAR3(GPR41)が知られている。うちGPR43を欠損したマウスでは正常マウスと比べて、肝肥大の増悪・肝コレステロールの増加・血中ALTの上昇といった病態の悪化が観察され、イヌリンによるNAFLD/NASH抑制効果も消失した。
さらに、糖代謝・インスリン抵抗性を検討したところ、GPR43欠損マウスでは野生型マウスに比べて肝臓におけるインスリン抵抗性の増悪を認めたが、全身のインスリン抵抗性については影響しなかった。
以上より、プレバイオティクスの分解によって腸内細菌が産生する酢酸は、GPR43を介して肝臓特異的にインスリン抵抗性を改善し、NALFD/NASHの病態形成を抑制していることが判明した。
研究は、慶應義塾大学薬学部の長谷耕二教授、慶應義塾大学医学部の金井隆典教授、京都大学大学院生命科学研究科の木村郁夫教授、オーストラリア連邦科学産業研究機構のJulie M. Clarke氏らの国際共同研究グループによるもの。研究成果は、学術誌「Microbiome」に掲載された。
「研究では、腸内細菌由来の酢酸によるNAFLD/NASH抑制効果とその分子メカニズムを明らかにしました。今後は、本研究成果をもとに、酢酸の産生増強を目的としたより効果的な次世代プレバイオティクスや肝臓のGPR43に対する分子標的薬など、次世代NAFLD/NASH予防・治療法の開発につながることが期待されます」と、研究グループでは述べている。
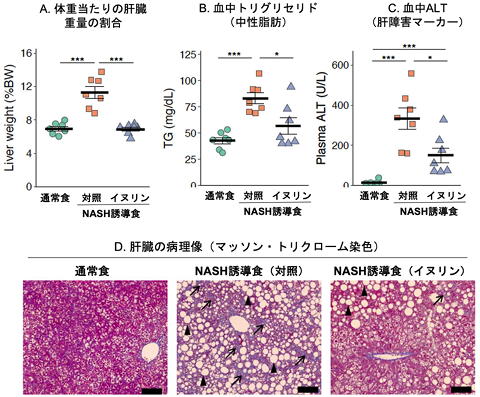
NASH食摂食によって肝肥大(A)、血中中性脂肪(B)・肝障害マーカー(C)、肝臓の繊維化(D: 矢印)、および風船様肝細胞(D: 矢頭)が誘導されるが、これらの指標はいずれもイヌリンの摂取によって改善した。
慶應義塾大学薬学部 生化学講座
Commensal microbe-derived acetate suppresses NAFLD/NASH development via hepatic FFAR2 signalling in mice(Microbiome 2021年9月16日)












