肝臓由来の「アクチビンB」が糖代謝を制御する新たな仕組みを発見 糖尿病のすべての病態を改善する治療薬の可能性
肝臓由来のタンパク質「アクチビンB (Activin B)」が糖代謝を改善する新たな仕組みが、国立健康危機管理研究機構や東京大学などの研究で発見された。
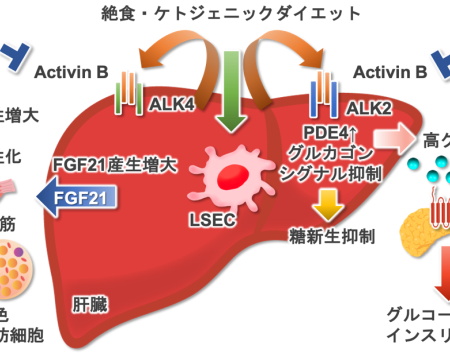
アクチビンBは、肝類洞内皮細胞で産生され、全身の糖・エネルギー代謝を制御しているという。アクチビンBは、肝臓のFGF21産生を亢進させインスリン感受性を改善し、肝臓でのグルカゴンの働きを阻害して空腹時血糖を低下させ、二次性に増加したグルカゴンがGLP1受容体を刺激してインスリン分泌を増加させ食後の血糖上昇を抑制することが明らかになった。
肝臓でアクチビンシグナルを活性化する薬剤を開発できれば、1剤で糖尿病のほぼすべての病態を改善できる治療法を実現できる可能性があるとしている。
肝臓由来のタンパク質「アクチビンB」が糖代謝を制御する新たな仕組みを発見
肝臓由来のタンパク質「アクチビンB (Activin B)」が糖代謝を改善する新たな仕組みが、国立健康危機管理研究機構や東京大学などの研究で発見された。
研究は、国立健康危機管理研究機構(JIHS)糖尿病研究センターの植木浩二郎・センター長および分子糖尿病医学研究部の小林直樹上級研究員らのグループが、東京大学大学院医学系研究科の山内敏正教授、門脇孝・東京大学名誉教授、ドイツ・ライプツィヒ大学のMatthias Blüher教授らと行った国際共同研究。
研究グループは、アクチビンBは、肝臓でFGF21の産生を促進しインスリン感受性を高める一方で、肝臓のグルカゴンに対する反応性(グルカゴン感受性)を低下させることで、血糖を改善する仕組みを明らかにした。
また、肥満にともない、その作用を阻害するタンパク質であるFSTL3が増加することも示され、糖尿病の新たな治療標的としての可能性が示された。
アクチビンは、TGF-β(Transforming Growth Factor-β)スーパーファミリーに属するサイトカインの一種で、特定の受容体に結合することで細胞内シグナルを活性化し、さまざまな生理機能を制御する。とくに、生殖機能の調節、細胞や組織の発生・分化、さらには免疫応答や創傷治癒など、多岐にわたる生物学的プロセスに関与することが知られている。
またFGF21は、主に肝臓から分泌される内分泌性の線維芽細胞増殖因子(FGF)であり、ヘパトカインの代表的分子のひとつとして知られる。標的組織である脂肪組織などに作用し、インスリン感受性の改善、脂質代謝の促進、グルコース利用の増加など、エネルギー代謝全体の調節に関与する。近年では、肥満や2型糖尿病、非アルコール性脂肪肝疾患(MASLD)に対する治療標的として注目され、FGF21を基盤とした創薬の研究開発も進められている。
アクチビンBは、肝臓のFGF21産生を亢進させインスリン感受性を改善し、肝臓でのグルカゴンの働きを阻害して空腹時血糖を低下させ、二次性に増加したグルカゴンがGLP-1受容体を刺激してインスリン分泌を増加させ食後の血糖上昇を抑制する。

糖尿病のすべての病態を一剤で改善できる治療薬開発への期待
2型糖尿病では、インスリン分泌不全(膵β細胞からのインスリン分泌の低下)、インスリン抵抗性(骨格筋や肝臓などでのインスリンの作用の低下)など複数の病態が複雑に絡み合っている。これらに対処するため、さまざまな治療薬が開発されているが、単剤では十分な治療効果を得るのは難しく、重症化する例がしばしば認められる。
研究グループは、これら複数の病態の“根本的な上流因子”が存在する可能性を念頭に、しばしば糖尿病発症のきっかけになる軽度の肥満から発現が上昇する分子を、ヒト脂肪組織検体を用いた網羅的な遺伝子発現解析により探索した。
その結果、TGF-βスーパーファミリーの拮抗因子として知られるFSTL3(Follistatin-like 3)が肥満で有意に増加しており、これはアクチビン分子の機能阻害を通じて代謝制御に影響する可能性があることを突き止めた。
研究グループは次に、マウスでアクチビンサブユニット(Inhba, Inhbb, Inhbc, Inhbe)の発現を解析し、Inhbb遺伝子は絶食時やケトジェニック食摂取時に肝臓、なかでも肝類洞内皮細胞で顕著に発現増加しており、代謝調節に関与する可能性を明らかにした。
Inhbb遺伝子がコードするタンパク質「アクチビンB」の作用を詳細に検討するため、肥満マウスモデルでアクチビンBを過剰発現させたところ、耐糖能の改善、インスリン感受性の向上、さらにはグルコース応答性インスリン分泌の亢進が認められた。
長期の観察では、体重減少が認められ、エネルギー消費の増加、褐色脂肪組織の活性化といったエネルギー代謝の改善も確認された。
その作用メカニズムを検索した結果、絶食時に肝臓で分泌される代表的なヘパトカインであるFGF21が、アクチビンBにより強く誘導されることが判明した。
さらにFGF21欠損マウスを用いた検討により、アクチビンBによるインスリン感受性の改善にはFGF21が必要であることを明らかにした。
一方で、耐糖能やインスリン分泌の改善効果はFGF21非依存的にも存在することも分かり、アクチビンBには複数の経路による代謝調節作用があることが示唆された。
さらに、インスリン分泌不全の1型糖尿病モデルマウスでも、アクチビンBは血糖降下作用を示した。一方で、アクチビンB欠損マウスでは肝糖産生が増加し、インスリン非存在下でも高血糖が悪化した。
これは、アクチビンBが肝臓におけるグルカゴン作用を抑制し、いわゆる「肝グルカゴン抵抗性」を誘導するためであることを突き止めた。
さらに注目すべきこととして、アクチビンBの作用による血中グルカゴン濃度の上昇を挙げている。これは、肝グルカゴン抵抗性が膵α細胞からのグルカゴン分泌を促すという「肝-膵 α 細胞連関」にもとづく現象としている。
このグルカゴンの上昇は、膵β細胞上のGLP-1受容体を介してインスリン分泌を促進するという近年報告された経路を通じ、食後血糖のコントロールにも寄与していることが、アミリン誘導体によるグルカゴン分泌阻害実験およびGLP-1受容体阻害実験から示唆された。
「以上の結果から、アクチビンBは糖尿病の主要な病態である空腹時血糖の上昇、インスリン分泌不全、インスリン抵抗性のすべてに作用しうる新たな代謝制御因子であることが示されました」と、研究者は述べている。
「とくにFGF21の誘導と肝グルカゴン感受性の制御を介した二重の作用は、従来の薬剤では困難だった病態の同時制御を可能にする可能性があります。今後は、アクチビンBのシグナルを活性化する薬剤や、阻害因子FSTL3の発現を制御する介入法の開発を通じて、糖尿病および肥満に対する新規治療戦略の構築が期待されます」としている。
国立健康危機管理研究機構 国立国際医療研究所 糖尿病研究センター
Activin B improves glucose metabolism via induction of Fgf21 and hepatic glucagon resistance (Nature Communications 2025年4月17日)











