【新型コロナ】すべての変異型を逃さない治療薬候補を開発 感染力が強い変異株に対しても良好な中和活性
変異株による治療効果の減弱が起こらないことを確認
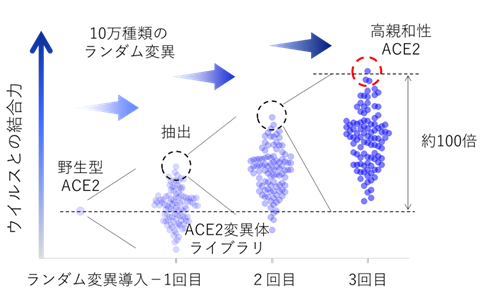
京都府立医科大学や大阪大学などの研究グループは、新型コロナウイルスの感染受容体であるACE2タンパク質を、指向性進化法と呼ばれるタンパク質工学的手法により改変し、ウイルスとの親和性を約100倍高めることに成功した。
この手法は、DNAの突然変異誘発による多様化と選択のサイクルを繰り返すことで、自然界にはみられない高性能なタンパクを作出する技術。
この高親和性ACE2を用いた中和タンパク質「改変ACE2受容体」が、ハムスターのCOVID-19モデルで高い治療効果を示したことも確認した。
ウイルスには、遺伝子を変異させることで、抗体や化合物の標的部位の形状を変化させ、結合できなくすることで薬剤耐性を獲得する逃避変異という作用がある。
中和抗体などの抗体製剤は、薬剤耐性をきたす逃避変異が問題となるが、同改変ACE2受容体は、新型コロナウイルスの感染受容体であるACE2タンパク質を用いているため、逃避変異株の出現は観察されず、感染症を克服するまで使い続けることができるという。
改変ACE2受容体は、これまでに問題となってきた感染力が強いN501Y変異や免疫逃避型E484Kを持つ変異株に対しても良好な中和活性を示すことも確認した。
研究は、京都府立医科大学大学院医学研究科循環器内科学の星野温助教、大阪大学蛋白質研究所の高木淳一教授、高等共創研究院の岡本徹教授(微生物病研究所兼任)らの研究グループによるもの。研究成果は、英科学誌「Nature Communications」に掲載された。
指向性進化法によりウイルスとの結合力を高めるのに成功
これまでにCOVID-19治療薬として新規に創製され開発され使用されているものは中和抗体製剤のみだが、抗体製剤ではウイルスが変異によって薬剤から逃れる逃避変異が問題となっている。
実際に、これまでに開発された抗体製剤のいくつかは効果が消失する変異株が存在するため、複数の抗体を混ぜてカクテル製剤として用いる対応がとられている。そのため、COVID-19のような新興のウイルス感染症では、迅速に開発ができ、逃避変異が生じずに一度開発すれば感染症を克服するまで使用が可能な治療薬が求められている。
研究グループは、迅速に開発ができ、逃避変異が生じない治療薬として、新型コロナウイルス感染受容体であるACE2に着目して開発に取り組んだ。
重鎖定常領域(Fc領域)は、抗体の"Y"字の下半分の縦棒部分にあたる部分で、免疫細胞や補体と結合することで抗体が抗原と結合した後の免疫反応を媒介する。
今回採用した、受容体の細胞外領域をヒト免疫グロブリンIgG1のFc領域とつなげた融合タンパク製剤は、すでに関節リウマチなどの治療薬として実用化されている。
しかし、ACE2の場合は新型コロナウイルスとの結合力がそれほど強くなく、通常のタンパク製剤の血中濃度では有効な中和活性を示さない。そこで、指向性進化法を用いて、ウイルスとの結合力を高めることに取り組んだ。
まず、増幅エラーが入りやすい核酸増幅法でACE2遺伝子にランダム変異を導入し、約10万種類のACE2変異体ライブラリを作製した。このライブラリを発現した細胞に新型コロナウイルスのスパイク(S)タンパク質を反応させて、強く結合したACE2変異体発現細胞を回収し、高親和性ACE2変異体の遺伝子を抽出した。
その後、この変異体遺伝子に再度10万種類のランダム変異を追加したライブラリを作製し、そこからさらに高親和性の変異体遺伝子を抽出した。今回はこのサイクルを3回繰り返すことで、野生型ACE2タンパク質よりウイルスとの結合力が約100倍亢進した高親和性ACE2を3種類取得することに成功した。
新型コロナだけでなく将来の新たなウイルスパンデミックにも対応
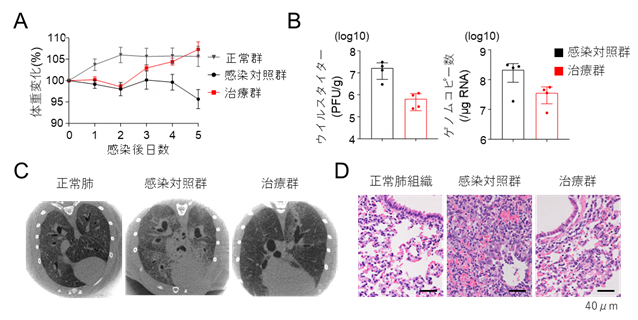
B:肺組織のウイルスタイターとRNAゲノムコピー数。
C:CT画像。感染対照群で認めるすりガラス陰影は改変ACE2受容体を投与した治療群で抑制されている。
D:肺病理所見。感染対照群では肺胞出血や炎症細胞浸潤が顕著だが、治療群では著明に抑制されている。
COVID-19モデル動物実験はハムスターを用いて行った。鼻粘膜にウイルスを感染させた後に改変ACE2受容体を投与し、体重変化と肺炎所見を評価した。
その結果、ウイルス感染により対照群では体重が4.3%低下したが、改変ACE2受容体投与治療群では7.3%増加し、非ウイルス投与群(非感染対照群)と同等まで回復した。また、肺組織のウイルス量も10分の1程度まで抑制され、CT画像でもウイルス投与により広範囲にすりガラス陰影が出現するのに対し、治療群では陰影が顕著に減少した。また、肺病理組織では治療群で肺胞出血や炎症細胞浸潤が少なく、肺炎の重症化も抑制された。
新型コロナウイルスの感染受容体ACE2にもとづく改変ACE2受容体では、ウイルスが変異により改変ACE2受容体に結合しなくなった場合、細胞表面のACE2とも結合できずに感染力を失うことになる。そのため、実質的に逃避変異が生じないと考えられるという。
この仮説を、ウイルスに対する耐性株が出現しやすくなる評価系(改変ACE2受容体を部分的有効濃度にして新型コロナウイルスの培養を繰り返す)を用いて確認した。その結果、コントロールとして用いたモノクローナル抗体(中和抗体)では、4継代目で完全に耐性株に置換されたが、改変ACE2受容体では15継代を経ても耐性株は出現せず、実際に逃避変異が出現しないことが確認された。
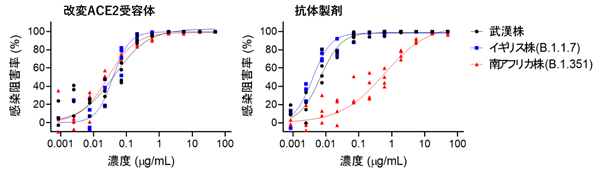
さらに、現在脅威となっているウイルス変異株についても、感染力が強いN501Y変異をもつイギリス株(WHO分類:α株)に対しても有効で、ワクチンや一部のモノクローナル抗体が効きにくい免疫逃避型E484K変異をもつ南アフリカ株(WHO分類:β株)に対しては、現在米国で使用が許可されているリジェネロン社のREGN10933抗体は中和活性の大きな低下が認められたが、改変ACE2受容体では中和活性が良好に維持されることを確認した。
改変ACE2受容体と抗体製剤での各種変異株に対する中和活性
「新型コロナウイルスの受容体であるACE2タンパク質のウイルス親和性を高めることで、抗体製剤と同等の中和活性を有し、かつ逃避変異に抵抗性である高親和性ACE2変異体の作出が可能であることが証明されました」と、研究グループでは述べている。
また、ACE2を利用した中和タンパク質(受容体)で、COVID-19モデル動物実験で治療効果を証明したのは今回の研究が最初になる。さらに、今回のACE2変異体では、ウイルスのスパイク(S)タンパク質との複合体の立体構造の決定にも成功し、高親和性獲得のメカニズムが明らかにできただけでなく、体内寿命が長い安定なタンパク質製剤をデザインするヒントも得られたとしている。
「今回の指向性進化法による高親和性ACE2変異体の作出は1ヵ月程度で可能で、また抗体製剤とは異なり患者検体を必要としない利点もあります。今回のCOVID-19だけでなく将来の新たなウイルスパンデミックにおいても、薬剤耐性株出現の懸念なく迅速な治療薬開発が可能な新規モダリティとして期待されます」と、研究グループでは述べている。
京都府立医科大学大学院医学研究科循環器内科学
大阪大学蛋白質研究所
Engineered ACE2 receptor therapy overcomes mutational escape of SARS-CoV-2(Nature Communications 2021年6月21日)











