GLP-1受容体作動薬「オゼンピック皮下注SD」が出荷停止 最新の出荷状況 代替品への切替での注意点
欧州の提携製造会社にGMP上の指摘 製造と輸出を一時的に中止
同社は「医療関係者の皆様におかれましては、オゼンピック皮下注SDについて当面の間、新規患者さまへのご処方を控えていただくとともに、ご処方ベースにてご購入および代替品への切替についてご検討をお願いいたします」としている。
これは、オゼンピック皮下注SDの製造工程を欧州の提携製造会社に一部委託しており、2021年12月にその会社より、FDA査察におけるGood Manufacturing Practices(GMP)上の指摘にもとづき、製造と輸出を一時的に中止したとの報告を受けたもの。その提携製造会社からは、このGMPに関する問題解決には時間を要するとの報告を受けているという。
代替薬投与にあたっては、血糖自己測定または血液検査などで、「適宜血糖値をモニターし、急激な血糖コントロールの悪化にはご注意いただくよう」呼びかけている。
また、2018年に承認を取得している、用量調節が可能な複数回投与ペン型注入器のオゼンピック皮下注2mgについては、「現在、薬価収載を目指して準備を行っており、できる限り早い時期に日本の患者さまにお届けできるよう最善を尽くします」としている。
【4月4日時点の出荷状況】
| オゼンピック皮下注0.25mg SD | 出荷停止 |
| オゼンピック皮下注0.5mg SD | 出荷停止 |
| オゼンピック皮下注1.0mg SD | 出荷調整 |
患者が適切な治療を継続して受けられるよう強く要望
これを受けて、日本糖尿病学会と日本糖尿病協会は2月14日に、「オゼンピック皮下注 SD の製造輸出一時中止に伴う出荷調整への対応について」を公開した。
「安定供給が確保されるまでの間、オゼンピックを新規に処方しないでください。欠品を見越した大量処方は決してしないでください」「欠品となった場合には、患者の希望や生活様式を考慮して、代替薬への切り替えを行ってください」などと注意を促している。
「欠品のため2型糖尿病の治療中断や血糖コントロール悪化が危惧される事態は誠に遺憾であり、患者が適切な治療を継続して受けられるよう強く要望しているところであります」としている。
さらに、両者は2月23日に、厚生労働省医政局長に対し「要望書」も出しており、「かねてより学会および協会は、GLP-1受容体作動薬の美容・痩身・ダイエットなどを目的とした適応外使用は認められていないことの周知に努めてきましたが、地域的な在庫逼迫の背景には、美容など自費診療クリニックの当該薬剤の大量確保や、医薬品卸売会社などの流通過程における不適切な出荷の偏りの疑いが払拭できません」としている。
「糖尿病患者が大きな不利益を被ることになりますので、2型糖尿病治療以外の診療用途に当該薬剤が用いられることのないように、医薬品卸売会社などの流通関係者にご指導をお願い申し上げます」と、注意を促している。
他のGLP-1受容体作動薬に切り替えた際の注意点を公開
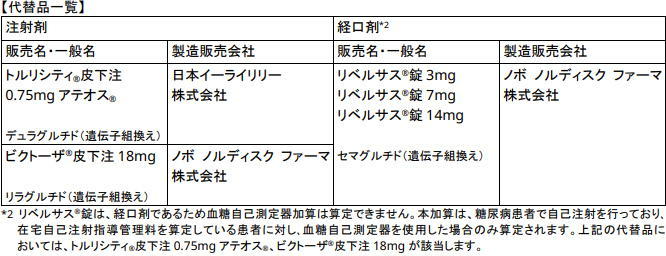
日本糖尿病学会と日本糖尿病協会は3月30日に、「オゼンピック皮下注SDの出荷停止に伴い類薬に切り替えた際の投与開始量について」を公開した。
「オゼンピック皮下注0.25mg SD、0.5mg SD、1.0mg SD」の製造と輸出一時停止による出荷停止にともない、投薬を受けていた2型糖尿病患者が、他のGLP-1受容体作動薬に切り替えざるを得ないケースが生じている。
切替え先の薬剤の用量が漸増規定となっている場合、血糖コントロールの悪化を防ぐため、投与開始時から維持量で投与する必要性が高いと医学的に判断される場面が少なくないと想定される。
両者は、「多くの場合ベネフィットが期待されますが、以下の点に留意が必要です」として、下記の注意点を指摘している。
1. 代替薬投与にあたっては、血糖自己測定または血液検査等で適宜血糖値をモニターし、急激な血糖コントロールの悪化に注意すること。
2. 胃腸障害が発現し持続する場合、減量を考慮し、さらに症状が持続する場合は、休薬を考慮すること。1~2日間の減量または休薬で症状が消失すれば、減量前または休薬前の用量の投与を再開できる。
3. 経口GLP-1受容体作動薬について、注射薬から切替え時に維持量で投与を開始した際の胃腸障害の頻度は不明であり、慎重に経過を観察すること。











