ブドウ糖代謝を調節する酵素「グルコキナーゼ」の抑制が、β細胞の量の低下を防ぐ 糖尿病の新規治療法開発へ

グルコキナーゼ抑制で糖尿病マウスの高血糖改善
研究は、北海道大学大学院医学研究院の中村昭伸講師、大森一乃客員研究員、渥美達也教授ら、横浜市立大学大学院医学研究科の寺内康夫教授の研究グループによるもの。研究成果は、米国糖尿病学会誌「Diabetes」にオンライン掲載された。
インスリンを産生・分泌する膵β細胞の機能・量の低下が2型糖尿病の病態の中心であり、これを保持する方法を確立することが、糖尿病の本質的治療につながる。
糖尿病状態で膵β細胞の機能・量が低下する要因のひとつとして、膵β細胞は高血糖により多くのブドウ糖を代謝して処理しなければならず、多くのストレスが生じた結果、機能・量が低下しインスリンが分泌できなくなり、さらなる高血糖が生じることが考えられる。
そこで研究グループは、膵β細胞や肝臓などに発現している、ブドウ糖代謝を調節する酵素であるグルコキナーゼに着目。グルコキナーゼの働きを抑制することで、過剰なブドウ糖代謝を適正化し、膵β細胞の機能・量の低下を予防しうる可能性を考えた。
グルコキナーゼの遺伝子発現が約半分であるグルコキナーゼヘテロ欠損マウスと肥満2型糖尿病のモデルマウスであるdb/dbマウスを用いて、グルコキナーゼヘテロ欠損db/dbマウスを作製。そして、グルコキナーゼが欠損していないdb/dbマウスを対照とし、血糖値、生存期間、膵β細胞機能・量、発現遺伝子、ミトコンドリアの形態、代謝産物などについて比較検討した。
その結果、db/dbマウスに比べ、グルコキナーゼヘテロ欠損db/dbマウスでは、膵β細胞量、インスリン分泌量が多く、高血糖が改善し、生存期間も長くなっていることが判明。
また、グルコキナーゼヘテロ欠損db/dbマウスの膵島では、db/dbマウスの膵島に比べ、ストレス関連遺伝子の発現が減少しており、膵β細胞の機能や成熟に重要な転写因子であるNkx6.1やMafAの発現が上昇していた。
さらに糖尿病マウスでみられるミトコンドリアの形態異常およびブドウ糖代謝パターンの異常が、グルコキナーゼヘテロ欠損db/dbマウスで改善していることがわかった。
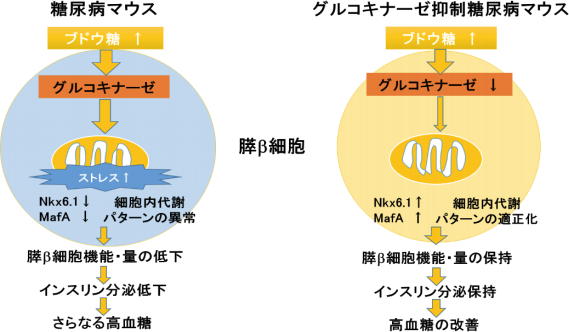
以上の結果より、グルコキナーゼの働きを抑制することで過剰なブドウ糖代謝が適正化され、膵β細胞機能・量の低下を防ぐことを実証。さらに、その結果、糖尿病マウスの血糖値を改善し、生存期間も延長させることを明らかにした。
今回発見した「膵β細胞内の過剰なブドウ糖代謝を適正化することにより、糖尿病でみられる膵β細胞機能・量の低下を予防する」という方法は、新たな糖尿病の予防法・治療法になる可能性がある。「グルコキナーゼの抑制は糖尿病の本質的治療につながる可能性があります。今後、創薬などを通じて、臨床応用に展開できることが期待されます」と、研究グループは述べている。
北海道大学大学院医学院・医学研究院 免疫・代謝内科学教室
横浜市立大学大学院医学研究科
Glucokinase inactivation paradoxically ameliorates glucose intolerance by increasing











