CKD・糖尿病性腎症の疾病管理~バイオマーカーL-FABPの可能性~

第57回 日本糖尿病学会年次学術集(モーニングセミナー2より)
尿蛋白の排泄は、腎障害の結果であり、原因でもある
CKDは、腎の構造的または機能的異常が3カ月以上持続する病態と定義されている。CKDが進行し末期腎不全に至ると透析や移植が必要になることはよく知られているが、それだけではなく病期の進行とともに心血管疾患を発症する危険が高くなることが重要であり(図1)、それが今日、CKDが注目されている理由である。そしてそのCKDの代表が糖尿病性腎症であることは、国内における透析導入原疾患のトップを占めていることにからも明らかである。

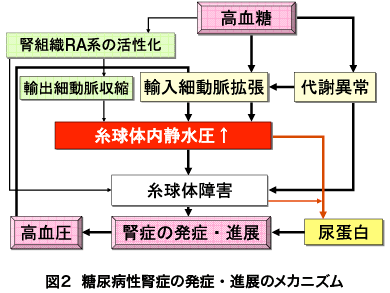
高血糖によって輸入細動脈が拡張し糸球体内静水圧が上昇して糸球体が障害され、その結果生じる高血圧や尿蛋白排泄、あるいは高血糖に伴う腎組織RA系の亢進、種々の代謝異常の修飾が加わり、腎障害の進行が加速するというのが糖尿病性腎症の単純化したメカニズムであるが(図2)、ここで注意すべきことは、尿蛋白は腎障害の結果として現れるばかりでなく、腎障害の原因にもなっているという点である。
アルブミンに結合する脂肪酸が腎障害性を増大させる

座長の和田隆志氏
尿蛋白の主成分はアルブミンだが、我々はそのアルブミンに結合している遊離脂肪酸に着目し、糸球体障害のないマウスの腹腔内にウシ血清アルブミンを投与したところ、間質尿細管に強い炎症を生じることを確認した。脱脂して脂肪酸を除去したアルブミンでは糸球体障害が軽度であったことから、尿蛋白に結合した脂肪酸が腎障害を起こすと考えられた。このアイデアをもとに基礎研究を進め、培養近位尿細管細胞への脂肪酸結合蛋白の添加によってMCP-1等の炎症性サイトカインの発現が亢進することなどを報告してきた。また臨床的には、ネフローゼ症候群と糖尿病性腎症の患者を比較すると、尿蛋白排泄レベルが同程度であっても後者のほうが尿中脂肪酸の量が多く、腎障害性が強いことが示唆される。

演者の木村健二郎氏
尿蛋白の排泄が腎障害を加速するという事実は、大規模臨床研究でも示されている。例えばロサルタンの腎保護効果を検証したRENAAL研究では確かに同薬の効果が確認されたが、研究が始まって6カ月の時点での尿蛋白レベルが同等であればその効果はプラセボと変わらないと報告されている。つまり、腎保護効果は尿蛋白減少効果に依存するということだ。
以上をまとめると、糖尿病性腎症の進展抑制には、まず血糖と血圧のコントロールにより糸球体内圧を下げること、そして尿蛋白を減らすことが重要と言える。腎保護効果は個別化医療によって、もたらされる
実際、血糖や血圧、あるいは脂質を集学的治療で厳格に管理することで、腎症進展のみならず心血管疾患を抑制可能であることは、既にSteno-2研究によって示されている。ところが、その後行われたACCORD研究では、さらに強力に薬剤介入したが、結果はよく知られているように、かえって有害事象が増えてしまった。その反省から、厳格な管理目標を一律に定めるのではなく、個々の患者の状態にあわせてゴールを柔軟に設定することが重要であると考えられるようになった。
昨年改訂された日本腎臓学会の『エビデンスに基づくCKD診療ガイドライン2013』でもこの点を重視しており、糖尿病の有無と病期別に降圧目標を設定しているほか、各病態における推奨降圧薬やそれら治療の推奨グレードを明記している。
個別化医療の具現化には新たなバイオマーカーが必要
では、個別化医療を実践するには何を指標とすればよいのであろうか。
冒頭に述べたようにCKDの治療目的は、腎機能低下の進行とそれに伴い増大する心血管疾患の危険性を抑制することにある。そこで問題になるのは現在用いられている血清クレアチニン値やeGFRでは、病期の把握が常に後手に回るということだ。血清クレアチニン値が上がるということは既に腎機能が低下してしまっていることにほかならず、それが上がる前の段階で、予後予測や治療強化の必要性を把握できる何らかのバイオマーカーがなくてはならない。
このような視点で今、我々が注目しているのが、尿中に排泄されるL型の脂肪酸結合蛋白、L-type fatty acid binding protein '尿中L-FABP'だ。
尿中L-FABPは近位尿細管の脂肪酸ストレスを反映する
L-FABPは近位尿細管上皮細胞の細胞質に発現しているわずか14kDaの低分子量蛋白で、貝殻状の構造をしており脂肪酸と結合する。糸球体からはアルブミンが1日約7g漏出しているが、腎機能が正常であればその大半が近位尿細管で取り込まれ、ライソゾームでアルブミンが加水分解される。一方、脂肪酸にはL-FABPが結合して細胞内小器官のミトコンドリアやペルオキシソームに輸送されて、β酸化を経てエネルギー源となる。
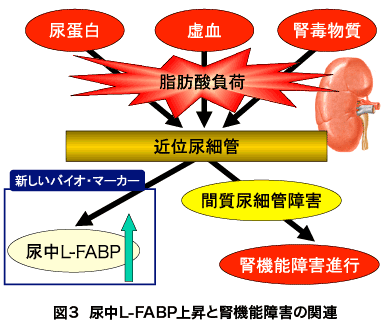
何らかの原因で漏出するアルブミン量が多くなると、近位尿細管の細胞質内で処理しきれない脂肪酸が増加し、それらは容易に過酸化を受けるため、尿細管間質に炎症が波及し障害が惹起される。このとき、脂肪酸の負荷によってL-FABPの発現が増強し、それが尿中に排泄される。
つまり、尿中L-FABPを測定することによって近位尿細管にかかる脂肪酸ストレスを推測でき、尿中L-FABPの高値は腎機能障害の進展リスクが高いことを意味する(図3)。近尿細管の脂肪酸ストレスを増大させるものとしては、先程から述べている尿蛋白のほか、腎虚血、腎毒性物質なども挙げられる。
尿中L-FABPによる糖尿病性腎症の発症・進展予測
尿中L-FABPは2011年に保険収載されたが、その算定条件には「(1)腎機能が低下する以前の糖尿病患者に対して、本検査を行うことにより糖尿病性腎症の病期進行リスクを判別し、また、治療効果の判定にも使用できる可能性がある。(2)急性腎障害が確立されていない、敗血症または多臓器不全などの患者に対し、治療転帰を含めた重症化リスクを判別することで、血液浄化療法などの適応判断に利用可能性がある。」と記されている。この(1)に関する我々のデータを紹介する。
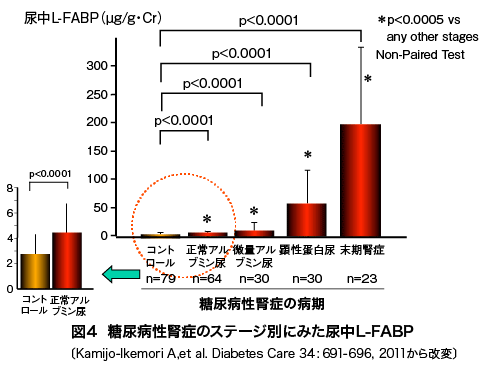
図4は2型糖尿病患者104名を4年間追跡した縦断研究において、登録時の糖尿病性腎症のステージ別にみた尿中L-FABPである。ステージの進行とともに尿中L-FABPが有意に高値になることがわかるが、そけだけではなく、微量アルブミン尿も呈していない正常アルブミン尿であっても非糖尿病のコントロール群に比して尿中L-FABPが有意に高値を示している。即ち尿蛋白がまだ排泄されていなくても、既に腎臓には糖尿病による何かしらのストレスがかかっているということだ。
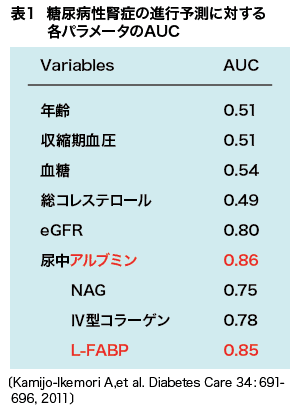
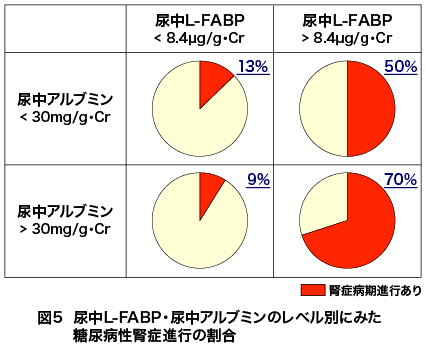
そして追跡開始から4年後の腎症進行に対する各検査指標の予測能をROC曲線下面積(AUC)で比較した結果が表1だが、尿中L-FABPと尿中アルブミンが病期進行の優れた予測マーカーとして抽出された。そこでこの2項目をそれぞれの基準値で二分し合計4群に分け病期進行の予測能を比較すると、図5のように尿中L-FABPの予測能が高く、両者の併用によりさらに精度が向上することが示された。なお、尿中L-FABPによる予後予測については1型糖尿病患者を対象とする検討もデンマークで行われ、有用性が報告されている。
心血管イベントの予測にも尿中L-FABPが有用
続いて心血管疾患との関連を紹介したい。図6は本日の座長の和田先生が研究代表者として進められた厚生労働科学研究の結果で、糖尿病性腎症患者や、腎硬化症の患者を追跡し、尿中L-FABP、アルブミンおよびNAGといった複数のバイオマーカーの有用性を比較したものである。複合エンドポイントとして、脳卒中、心筋梗塞、手術を要するASO、透析導入、死亡という、ハードエンドポイントを設定している。結果は尿中L-FABPのAUCが0.825で、三つの指標の中でリスク予測能が最も高かった。

ただ、ここまでに紹介したデータはある一時点の検査値からの予後予測について検討したものである。仮に治療介入後の検査値の変動が予後と相関するのであれば、実臨床においてさらに重視すべきマーカーとなり得るだろう。この点についても、和田先生の班研究で検討が進められており、まだ途中経過ではあるが有望な可能性を示す成績が報告されている。
観察開始時と1年後の各指標の変動で4群に別け(正常から異常、異常から正常、正常の持続、異常の持続)、累積エンドポイント到達率を比較すると、正常を持続した群の到達率が低く、異常を持続した群で到達率が高いのは当然ながら、正常から異常、または異常から正常への変化が到達率に影響していたのは尿中L-FABPのみであった。
AKIの重症度・治療効果判定、および治療手段としてのL-FABP
このほか、本日のテーマからやや離れるが、尿中L-FABPは急性腎障害(AKI)の重症度判定や治療効果判定、経過観察において、血清クレアチニンなどに比して、より鋭敏な指標であることが報告されている。またL-FABPは腎臓に負荷を与える脂肪酸に結合して排泄するものであることから、それ自体は腎保護作用があると考えられ、実際にそのことを示唆する報告も増えてきている。
これらL-FABPの新たな可能性を探るために、今後さらに検討を続けていく必要があるだろう。モーニングセミナー2 第4会場(大阪国際会議場10F Room1001-2)
演題:CKD・糖尿病性腎症の疾病管理~バイオマーカーL-FABPの可能性~
座長:金沢大学大学院医薬保健学総合研究科血液情報統御学教授 和田隆志 氏
演者:聖マリアンナ医科大学腎臓・高血圧内科教授 木村健二郎 氏
共催:株式会社特殊免疫研究所、シミックホールディングス株式会社











