肥満や糖尿病を悪化させる腸内細菌を確認 腸内細菌を介した代謝疾患の発症・悪化メカニズムを解明 理研
腸内細菌バランスの乱れが肥満・糖尿病を悪化
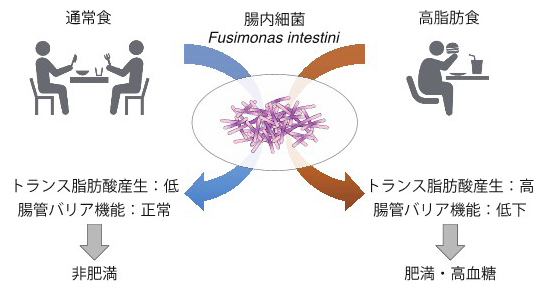
腸内細菌は、肥満や2型糖尿病といった代謝疾患にも深く関与していることが知られているが、どの腸内細菌が、どのようにそれらを悪化させるか、そのメカニズムはよく分かっていない。
健全な腸内細菌バランスから逸脱している状態は、「ディスバイオーシス(dysbiosis)」と呼ばれ、最近の研究で、さまざまな病態に関与していることが分かってきた。肥満や2型糖尿病は、ディスバイオーシスが関与する代表的な病態とみられている。
腸内細菌は、食事由来成分の一部を代謝することで低分子化合物(代謝物)を産生し、結果として食事がもたらす健康・病態への影響に関与していると考えられている。
理化学研究所の研究グループは今回、これまでの報告で肥満や高血糖との関連が示唆されている「Fusimonas intestini(FI)」という細菌に着目した。
その結果、この細菌は、肥満や糖尿病の患者から多く検出され、高脂肪食摂食マウスに投与すると肥満が悪化することや、トランス脂肪酸など肥満・高血糖を悪化させる代謝物を多く産生することを発見した。
腸内の"悪玉菌"がトランス脂肪酸を多く産生
トランス脂肪酸は、不飽和脂肪酸のうち、トランス型の二重結合を持つ脂肪酸。LDLコレステロールを増加させ、心血管疾患を引き起こすことが知られており、国際的に使用・摂取が厳しく制限されている。
このうちエライジン酸は、炭素数18のトランス脂肪酸であり、主要な食事由来トランス脂肪酸だ。
「腸内細菌が、食事由来成分に反応して産生する物質に着目することで、肥満や2型糖尿病などの代謝疾患と腸内細菌を結ぶ新しいメカニズムが見いだせる可能性があります」と、研究グループでは述べている。
「Fusimonas intestiniをはじめとする、トランス脂肪酸を産生する細菌をターゲットとした除去療法などが、肥満・糖尿病の改善につながる可能性があり、また、腸内細菌のfadR遺伝子が脂肪酸の産生に重要である点も明らかになったことで、細菌そのものではなく、細菌の脂肪酸産生遺伝子をターゲットとした治療の開発も考えられます」。
「健全な食事は、腸内細菌のディスバイオーシスを防ぐ意味でも重要であると考えられており、悪玉脂質やその産生細菌を抑えるという観点から食事の有効性を検証していくことで、治療のみならず疾患予防に資する可能性も期待できます」としている。
研究は、理化学研究所生命医科学研究センター粘膜システム研究チームの大野博司チームリーダー、竹内直志特別研究員(研究当時)らによるもの。研究成果は、「Cell Metabolism」にオンライン掲載された。
内臓脂肪重量も増加し、血糖値も悪化傾向に
肥満・糖尿病患者では悪玉菌の保有が2倍高い
腸内細菌は、食事由来成分の一部を代謝することで低分子化合物(代謝物)を産生し、結果として食事がもたらす健康・病態への影響に関与していると考えられている。
たとえば、肉などに含まれるリン脂質のホスファチジルコリンは、腸内細菌によりトリメチルアミンに代謝された後、体内に吸収され、動脈硬化を悪化させる物質に変換されることが分かっている。
研究グループは今回、Fusimonas intestini(FI)という細菌に着目。FIは、肥満・高血糖マウスから単離された細菌株であり、また、肥満や高血糖との関連性が示唆されているLachnospiraceae科という細菌種に属していることから、肥満・高血糖を悪化させている可能性がある。
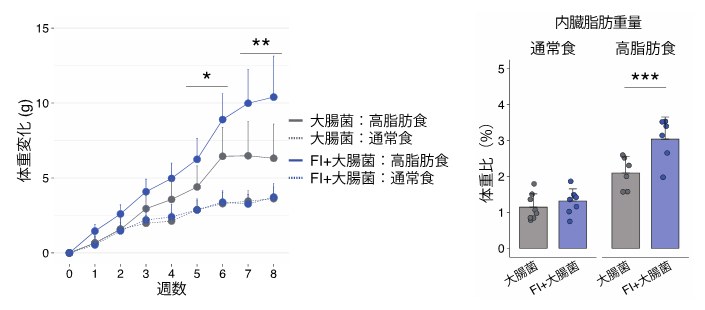
肥満・糖尿病患者と健常人各34人ずつの糞便検体を調べたところ、肥満・糖尿病患者ではFIの保菌率が健常人よりもほぼ2倍高いことが分かった(糖尿病患者:健常人=70.6%:38.2%)。さらに、保菌者のFIの菌数と空腹時血糖値や肥満度(BMI)は正の相関を示すことも分かった。
そこで研究グループは、無菌マウスにFIを投与し、FIの機能の解明を試みた。FI単独では無菌マウスに定着しなかったため、大腸菌のみを定着させたノトバイオートマウスを作製し、同マウスにさらにFIを定着させることで、比較実験を実施した。
高脂肪食の摂取により悪玉菌が健康を害する脂肪酸を産生
その結果、大腸菌単独定着マウスと比較してFI+大腸菌定着マウスでは、高脂肪食の摂食時に体重と脂肪重量が増加し、血中コレステロールが悪化した。また、血糖値も悪化する傾向も示された。
通常食では体重などに変化がないことから、FIは食事由来の脂肪に反応して代謝物を産生することで、高脂肪食による肥満の病態を悪化させる可能性を推測した。
そこで、大腸菌単独定着マウスとFI+大腸菌定着マウスの糞便中のメタボローム解析を実施し、水溶性代謝物(アミノ酸、糖など)および脂質代謝物(脂肪酸)を比較した。
その結果、水溶性代謝物は食事内容によらず大腸菌単独定着マウスとFI+大腸菌定着マウスで同じような一定のパターンが観察された。
一方、脂質代謝物は高脂肪食を与えたときのみ、FI+大腸菌定着マウスで大きくパターンが異なることが明らかになった。
具体的にどのような代謝物が変化しているかを詳しく調べたところ、トランス脂肪酸のエライジン酸、飽和脂肪酸のパルミチン酸など、ヒトの健康を害することが知られている脂肪酸が増加していた。さらに、FIを脂肪酸含有培地で培養したところ、エライジン酸の増加が確認された。
これらにより、FIが高脂質の環境下で健康を害する脂肪酸を産生することが明らかになった。
悪玉菌が産生するトランス脂肪酸が腸管バリア機能に影響 肥満や高血糖を悪化
研究グループは次に、腸内細菌による過剰な脂肪酸合成が肥満・高血糖につながるかを、別の実験モデルで検証した。
マスターレギュレーター遺伝子は、ある特定の代謝・分化経路で、とくに重要な役割を果たす遺伝子。細菌のfadR遺伝子は、脂肪酸合成のマスターレギュレーター遺伝子として知られている。
代表的なモデル細菌である大腸菌にfadR遺伝子を過剰発現させることで、トランス脂肪酸であるエライジン酸をはじめとする脂肪酸を多量に産生する細菌株を作製した。
この細菌株を無菌マウスに定着させ、高脂肪食を与えたところ、通常の大腸菌と比べて肥満や血糖値が悪化することが分かった。このことから、細菌由来の脂肪酸合成は、直接的に肥満・高血糖を悪化させる原因になりえることを明らかにした。
最後に、これらの脂肪酸がどのように肥満・高血糖を悪化させるのか、そのメカニズムを調べた。FI+大腸菌定着マウスの血液中の脂肪酸を調べたところ、脂肪酸はほとんど増加しなかった。
一方、腸内細菌が肥満・高血糖を悪化させるメカニズムのひとつとして、腸管バリア機能の破綻とそれにともなう細菌由来エンドトキシンの体内移行という仮説が以前から知られている。エンドトキシンは、グラム陰性桿菌の細胞壁を構成するリポ多糖で、少量が持続的に体内移行する場合には、脂肪組織などで慢性炎症を引き起こし、肥満や高血糖の悪化要因になると考えられている。
研究グループは、脂肪酸が腸管に影響を与えることで、間接的に肥満・高血糖を悪化させる可能性を考え、腸管バリア機能に重要な細胞接着分子であるタイトジャンクションの遺伝子発現を調べた。
その結果、FI+大腸菌定着マウスでは、大腸菌単独定着マウスと比較して低下していることが明らかになった。また、腸管上皮細胞を培養し、FI+大腸菌定着マウス由来の糞便脂質抽出物やエライジン酸を添加したところ、タイトジャンクションの遺伝子発現が低下した。
さらに、エライジン酸を肥満マウスに投与したところ、腸管バリア機能が低下したばかりでなく、同マウスの肥満や血糖値も悪化した。
以上の結果から、FIが産生するエライジン酸は、腸管バリア機能に影響を与え、肥満や高血糖を悪化させることが明らかになった。
理化学研究所 生命医科学研究センター 粘膜システム研究チーム
Fatty acid overproduction by gut commensal microbiota exacerbates obesity (Cell Metabolism 2023年1月17日)











