肥満による慢性腎臓病悪化の機序を解明 アディポリンがケトン体産生を介して内因性炎症を抑制 名古屋大学
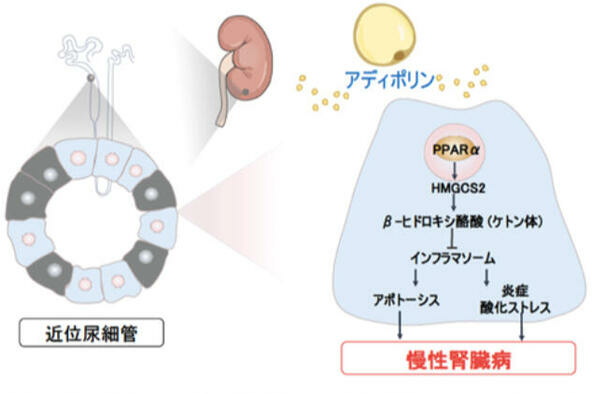
アディポリン投与で腎機能が改善
名古屋大学は2011年、肥満で血中濃度が低下し2型糖尿病を改善する新規脂肪由来因子としてアディポリンを発見した。これまでに、アディポリンが動脈硬化や心筋梗塞にも有益であることを報告してきた。今回、新たにアディポリンの慢性腎臓病に対する作用に着目した。
慢性腎臓病は国民の8人に1人が罹患する頻度の高い疾患であり、高率に腎不全に移行するため大きな社会問題になっている。肥満は糖尿病や高血圧を引き起こすことで慢性腎臓病を引き起こし、肥満そのものが慢性腎臓病の危険因子であることが明らかとなっている。
研究グループは、アディポリン欠損(APL-KO)マウスを作製し、対照の野生型(WT)マウスとともに6分の5腎摘手術(左腎臓3分の2と全右腎臓、合わせて6分の5を摘出することで、腎臓に負担をかける手術)を行い、2ヵ月後に腎機能を評価した。APL-KOマウスはWTマウスと比較して、血中の尿素窒素(UN)と尿中のアルブミン排泄が増加、すなわち腎機能増悪が認められ、アディポリンの全身投与で改善することを見出した。
アディポリンがケトン体産生を促進 腎臓を保護
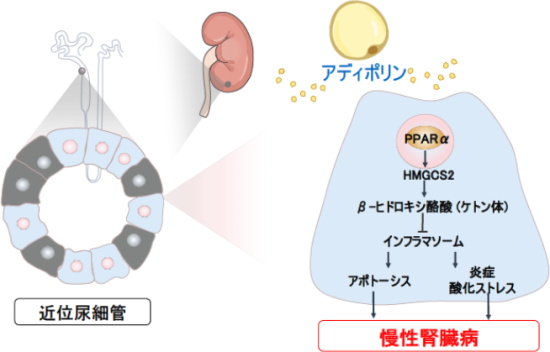
近年、ケトン体の臓器保護作用が多く報告されている。APL-KOマウスの腎臓では腎臓組織中のケトン体(βヒドロキシ酪酸)とケトン体合成酵素(HMGCS2)の発現が低下しており、アディポリンの補充によりHMGCS2発現とケトン体産生が増加していた。
増加したケトン体は、腎臓での内因性炎症(インフラマソーム)を抑制し、近位尿細管細胞のアポトーシスと、炎症性サイトカイン発現や酸化ストレスを抑制した。
研究グループは今回、インフラマソームを阻害することでAPL-KOマウスの腎機能増悪が完全に改善することで、アディポリンはケトン体産生を促進することで、インフラマソームを抑制し、慢性腎臓病から腎臓を保護することを世界に先駆けて発見した。
さらに、腎臓の近位尿細管細胞を用いた培養細胞の実験で、アディポリンがHMGCS2とケトン体産生を増加させるメカニズムに関しても、中性脂肪代謝を促進するPPARαという転写因子をアディポリンが活性化し、HMGCS2の発現を上昇させることをあわせて発見した。
血中ケトン体を上げず腎臓でケトン体を上昇させる薬剤の開発へ
研究は、名古屋大学大学院医学系研究科分子循環器医学(興和)寄附講座の大橋浩二特任准教授、大内乗有特任教授、循環器内科学の方麗欣大学院生、室原豊明教授らの研究グループによるもの。研究成果は、「iScience」にオンライン掲載された。
「現時点でアディポリンの受容体については明らかでなく、受容体の探索と受容体に作用する薬剤の開発が最終目標です。またインフラマソームは、痛風や慢性関節リウマチのような自己免疫疾患にも関与しており、インフラマソーム阻害剤の開発が進んできており、インフラマソーム阻害剤を用いた慢性腎臓病の治療法開発も視野に入れていく予定です」と、研究グループでは述べている。
さらに、「糖尿病患者でケトン体は血中濃度が上がり過ぎると、ケトアシドーシスという危険な病態になる可能性があるので注意が必要ですが、今回ケトン体の腎保護作用が明らかになったことをふまえ、血中濃度を上げ過ぎることなく、慢性腎臓病には保護的に働くように、腎臓でケトン体を上昇させる薬剤や食事療法の開発も進めていく予定です」としている。
名古屋大学 循環器内科
Adipolin protects against renal injury via PPARα-dependent reduction of inflammasome activation (iScience 2023年4月7日)











