「エネルギー消費の促進」による糖尿病や肥満の新たな治療を開発 褐色脂肪細胞の鍵因子がエネルギー消費を促進し炎症を抑制
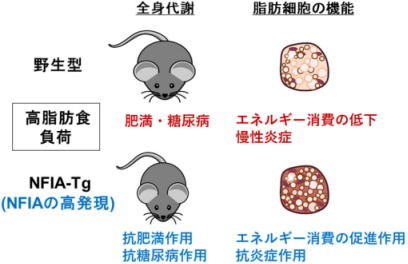
「エネルギー消費の促進」にもとづく糖尿病や肥満の治療法を開発
研究は、東京大学保健・健康推進本部の平池勇雄助教と大学院医学系研究科の山内敏正教授らの研究グループによるもの。研究成果は、「米国科学アカデミー紀要(PNAS)」に掲載された。
研究グループはこれまで、「エネルギー消費の促進」にもとづく糖尿病や肥満の治療標的として期待される褐色脂肪細胞の鍵因子として、転写因子「NFIA:nuclear factor IA」を同定している。
今回の研究で、脂肪細胞に高発現させた遺伝子改変マウスを作出し、NFIAがマウスで糖尿病や肥満を改善させることを明らかにした。
解析した結果、NFIAはエネルギー消費の促進作用に加えて、慢性炎症の抑制作用も有しており、双方を介して抗肥満や抗糖尿病の作用を発揮することを同定した。
既存の薬物治療や外科治療はすべて「エネルギー摂取の抑制」を意図しているが、NFIAは「エネルギー消費の促進」にもとづく糖尿病や肥満の治療標的、また「慢性炎症」を抑制するための治療標的となる可能性があるとしている。
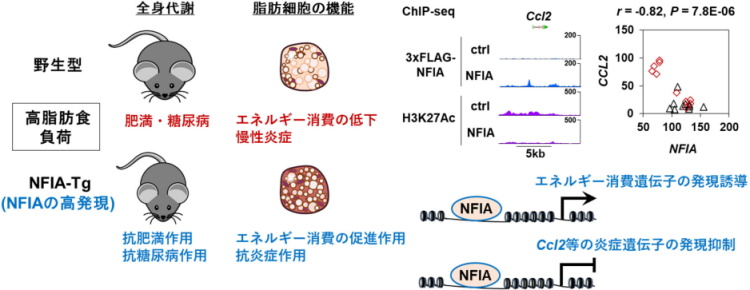
褐色脂肪細胞の鍵因子「NFIA」がエネルギー消費を促進 炎症も抑制
今回の研究で、脂肪細胞に高発現させた遺伝子改変マウスを作出し、NFIAがマウスで糖尿病や肥満を改善させることを明らかにした。
脂肪細胞には、脂肪滴としてエネルギーを貯蔵する機能が主体の「白色脂肪細胞」に加え、ミトコンドリアの代謝に関連する遺伝⼦「Ucp1」の作用を介して、エネルギーを消費し熱を産生する「褐色脂肪細胞」と呼ばれるサブタイプがある。
近年になってヒト成人で一定量の褐色脂肪細胞があり、さらにその活性が肥満の指標であるBMIと負に相関し、加齢にともない低下することが報告されている。褐色脂肪細胞は「エネルギー消費の促進」にもとづく糖尿病や肥満の治療標的として期待されている。
研究グループは今回、脂肪細胞でNFIAを野生型マウスと比較して5倍程度高発現させた「NFIAトランスジェニックマウス」(NFIA-Tg)を作出し、脂肪細胞でNFIAを高発現させることが、糖尿病や肥満の改善につながるか検証した。
その結果、NFIA-Tgは、高脂肪食負荷条件で野生型と比較して、全身のエネルギー消費量が亢進し、体重増加は抑制され血糖値の上昇も抑えられた。つまり、脂肪細胞のNFIAは、抗肥満作用と抗糖尿病作用を有していることが示された。
なお、NFIA-Tgでは、両群に体重差を認めない高脂肪食負荷の開始早期から、血糖値の上昇が抑えられており、NFIAは抗肥満作用と独立した抗肥満作用を有すると考えられた。
さらに、網羅的な遺伝子発現解析の結果、褐色脂肪細胞の遺伝子発現パターンは野生型とNFIA-Tgであまり差がなかったものの、白色脂肪細胞でNFIAが褐色脂肪細胞の遺伝子プログラムを活性化しミトコンドリアの機能を高めていることが分かった。
また予想外に、NFIAは白色脂肪細胞で高脂肪食負荷が惹起する慢性炎症を抑制する作用も有していた。NFIAは脂肪細胞から分泌され全身の炎症を促進し糖尿病や肥満を増悪させる因子として良く知られるMCP-1の発現を抑制し、結果として脂肪組織の炎症所見を改善させた。
実際、クロマチン免疫沈降と次世代シークエンスを組み合わせたChIP-seq解析によって、転写因子NFIAがMCP-1をコードするCcl2遺伝子の発現を負に制御することを明らかにした。
NFIAの発現量や活性を高める手法の開発へ
「ヒト脂肪組織でもNFIA遺伝子の発現量とCCL2遺伝子の発現量は負に相関しており、マウスのみならずヒトの脂肪細胞でもNFIAは抗炎症作用を有する可能性が示唆される」と、研究グループでは述べている。
今後の展望としては、少なくともマウスでは、脂肪細胞におけるNFIAの発現を高めることで糖尿病や肥満を治療できることが示されたことから、今後は低分子化合物の経口投与など遺伝子改変をともなわないかたちでNFIAの発現量ないし活性を高める手法を開発し、ヒトでの糖尿病や肥満の治療法に結実することを期待している。
また、NFIAがエネルギー消費の促進に関わる褐色脂肪細胞の遺伝子プログラムは正に制御する一方で、炎症に関わる遺伝子プログラムは負に制御するという「文脈依存的」な転写制御機構が、生物学的に興味深い研究対象であり、その制御機構の理解によって個々の病態により高精度に対応した糖尿病や肥満の治療につながることが期待されるとしている。
東京大学 保健・健康推進本部
東京大学 大学院医学系研究科 代謝・栄養病態学分野
NFIA in adipocytes reciprocally regulates mitochondrial and inflammatory gene program to improve glucose homeostasis (PNAS 2023年7月24日)











