ヒトiPS細胞由来の膵島移植が可能な1型糖尿病ミニブタの作製に成功 糖尿病に対するヒト細胞を用いた細胞移植治療を開発 京都大学iPS細胞研究所
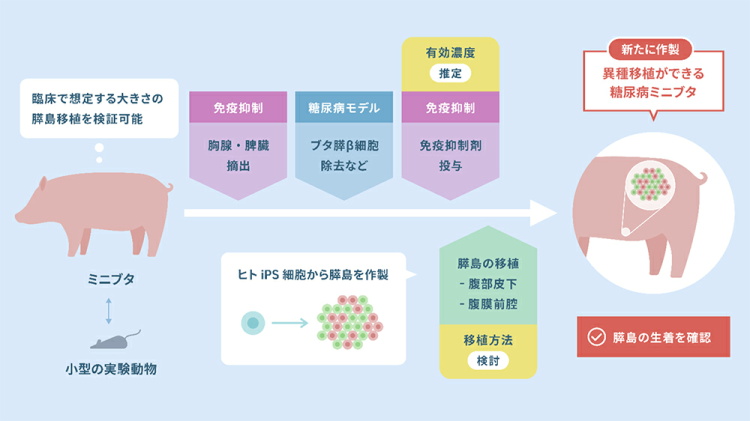
免疫抑制された1型糖尿病モデルのミニブタを作製 ヒトiPS細胞由来膵島細胞(iPIC)の生着を実証
京都大学iPS細胞研究所(CiRA)は、免疫抑制1型糖尿病モデルのミニブタの作製に成功したと発表した。ヒトiPS細胞由来膵島細胞(iPIC)の生着を確認し、血中でインスリン量の指標となるヒトC-ペプチドを検出した。
iPS細胞由来膵島細胞(iPIC)は、iPS細胞から膵β細胞などが集合した膵島に似た細胞集団を作ったもの。ヒトiPS細胞やES細胞などのヒト多能性幹細胞から作製した膵島様細胞の移植は、糖尿病の新たな治療法として期待されている。
一方で、細胞移植治療の実用化に必要なものの1つに、患者への移植に必要な膵島様細胞の検証がある。しかし、糖尿病のモデル動物として従来から広く用いられている小型のげっ歯類では、ヒトへの移植を想定した大きな移植物の検証ができないという課題がある。
そこで研究グループは、胸腺および脾臓を摘出したミニブタに膵β細胞を破壊する薬剤のストレプトゾトシン(STZ)を投与し糖尿病の病態を再現した。さらに、免疫抑制剤を投与することで、ヒト細胞の移植が可能な糖尿病ミニブタを作製した。糖尿病ミニブタへiPICの移植試験を実施したところ、腹部皮下および腹膜前腔への移植で生着が確認された。
「今回の研究は、糖尿病のためのヒト細胞を用いた細胞移植治療の開発で、臨床で想定されるサイズの移植物およびその移植手術手技の検討に役立つと期待される」と、研究者は述べている。
研究は、CiRA未来生命科学開拓部門、元タケダ-CiRA共同研究プログラム(T-CiRA)の豊田太郎氏、山﨑緑主任研究員(武田薬品工業グローバルアドバンストプラットフォーム)らの研究グループが、Axcelead Drug Discovery Partnersおよびオリヅルセラピューティクスとの共同で行ったもの。研究成果は、「Cell Transplantation」にオンライン掲載された。
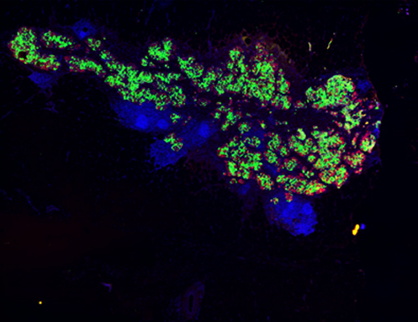
免疫抑制した糖尿病ミニブタにさまざまな方法で複数の部位にiPICを移植(スケールバー:500µm)。
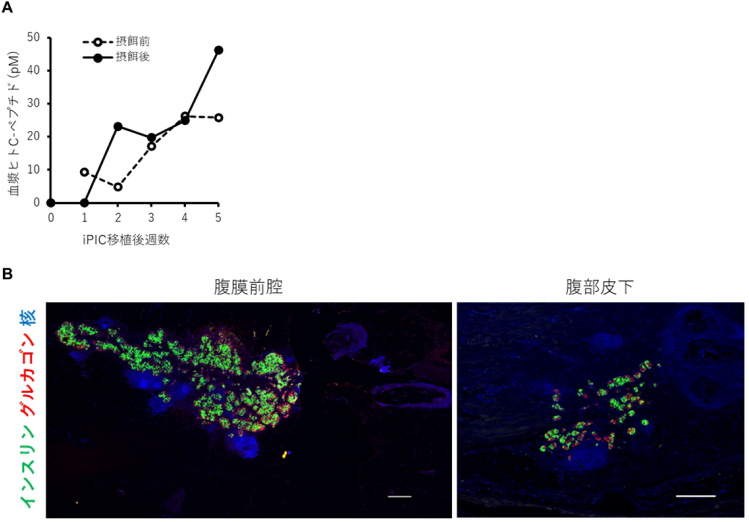
(B) 腹膜前腔(左)および腹部皮下(右)の代表的な免疫蛍光組織像
異種移植可能な糖尿病ミニブタを作製 iPS細胞由来膵島細胞の生着を検証
1型糖尿病は、膵臓でインスリンを分泌する膵β細胞が破壊されることによって発症する。膵β細胞は膵α細胞などと集まり、膵島と呼ばれる組織を形成している。膵島の各細胞で産生されるホルモンが、膵島を取り巻く毛細血管へと分泌され、血糖値の恒常性の維持に寄与している。
生体由来の膵島移植は糖尿病に対する根治療法の1つと考えられているが、移植に用いることのできる膵島を提供するドナーの不足が課題になっている。そのため、膵島ドナーを必要としない、ヒト多能性幹細胞(ES細胞およびiPS細胞)から膵島様細胞を作製し移植に用いる細胞治療の実現が期待されている。
移植用の膵島様細胞を作製する技術開発は急速に進んでおり、近年、ヒト多能性幹細胞から幼若期の膵島様細胞を作製し、1型糖尿病モデルマウスに移植することで糖尿病を治療できることが示されている。そして、これまでに臨床現場で蓄積されたドナー由来の膵島移植の知見から、1型糖尿病の患者への細胞治療にはヒト多能性幹細胞から作製した1億個(108個)以上の大量の膵島細胞の移植が必要と考えられている。
しかし、移植実験で従来から広く用いられている小型のげっ歯類は、患者への細胞治療で想定する大きさ・量の細胞や組織の移植を検証することができない。糖尿病についても、体重10kg以上の大型の動物で異種移植可能な動物モデルはこれまでになかった。
一方、実験動物用に小型化されたゲッチンゲンミニブタ(ミニブタ)に、免疫に関わる胸腺と脾臓を摘出する外科手術と免疫抑制剤を組み合わせることで、異種の細胞の移植試験に利用可能な免疫抑制状態を誘導できることが報告されている。
そこで研究グループは、外科手術と免疫抑制剤を組み合わせた免疫抑制ミニブタで、糖尿病状態を安定的に構築することで、異種移植可能な糖尿病ミニブタの作製に取り組んだ。そして同モデルに対して、ヒトiPS細胞由来膵島細胞(iPIC)が生着するかを検証した。
1型糖尿病ミニブタを用いて異種移植の評価が可能
研究グループはまず、ミニブタに対して免疫抑制状態を誘導するために外科手術を行い胸腺および脾臓を摘出した。これまでに、ストレプトゾトシン(STZ)の短期集中的な投与によりミニブタの膵β細胞を破壊すると、インスリンが大量に放出され、生命を脅かす低血糖のリスクが高まることが報告されている。そこで、血糖管理や液体食投与による低血糖リスク軽減の目的で、中心静脈(CV)カテーテルと胃ろうチューブを設置し、STZを投与した。
糖尿病の発症を確認するために、STZ投与前および投与後に静脈内ブドウ糖負荷試験(IVGTT)を行い、血糖値とインスリン分泌の指標となるブタC-ペプチドの血漿中濃度を計測した。
その結果、STZ投与後では血糖値は上昇し、血漿中のブタC-ペプチドレベルは減少した。ブタC-ペプチドがほぼ完全に枯渇したことから、ミニブタの体調を維持する目的でインスリンを毎日投与した。空腹時の血糖値はほとんどの測定点で200mg/dLを超えており、観察期間を通じて体重の減少はみられなかった。
これらの結果から、胸腺および脾臓を摘出したミニブタの体調を維持しながら、安定的に糖尿病が誘導できることが示された。
免疫抑制剤であるミコフェノール酸(MPA)とシクロスポリン(CsA)は、投与後の薬剤の吸収や作用などの薬物動態のばらつきが大きいことが知られている。そこで研究グループは、薬剤の有効範囲を推定するために、ミニブタの血漿および血中でのMPAおよびCsAの目標投与量を算出した。
まず、ミニブタの末梢血単核細胞(PBMC)の培養で、フィトヘマグルチニン(PHA)により誘導される細胞増殖を抑制するMPAおよびCsAの濃度を確認した。次に、薬効の期待できる血漿中濃度を計算した。
MPAおよびCsAは、血漿中および解析時の培地の中でタンパク質結合型と非結合型の2種の形態である。一般的に、非結合型の薬物濃度は薬効と関連すると考えられている。そのため、ミニブタ血漿中のMPAおよびCsAの非結合型分率をそれぞれ同定し、これを用いて、血漿中でのin vivo有効総濃度の目標レベルを推定した。さらに、CsAは主に血漿外、特に赤血球内に分布するため、同様の手順で、目標とする全血中濃度を推定した。
次に、これまでの検討から決定した免疫抑制糖尿病ミニブタの作製方針にもとづき、異種移植が可能であるか検証した。これまでの検討で推定していた用量で免疫抑制剤を投与したところ、重篤な副作用が発生した。このことから免疫抑制剤の投与量を減らした。
胸腺・脾臓を摘出した糖尿病ミニブタでの免疫抑制剤の処理により、異種細胞であるiPIC移植後の生着が可能かどうかを調べた。糖尿病状態の誘導から4週間後、免疫抑制剤の投与から1週間後に、皮下や腹膜前腔へのiPICの移植試験を行った。
iPICの移植後、摂食状態および空腹状態のヒトC-ペプチドの血漿中濃度をそれぞれ観察した。その結果、iPIC移植7日後にヒトC-ペプチドが血漿中で検出され、5週間かけて徐々に増加した。
今回の試験では、生着に適した移植条件を推定するため、さまざまな組成の物質とiPICを組み合わせて移植した。移植した部位の組織を収集し、移植条件による違いを分析した結果、フィブリンゲルを用いた腹部皮下や腹膜前腔への移植条件で、組織中にiPICを観察することができた。また、腹膜前腔では皮下よりも多くのiPICを観察することができた。一方で、他の移植片ではiPICがほとんど観察されなかった。
これらの結果は、免疫抑制された1型糖尿病ミニブタを用いて異種移植条件を評価することが可能であることを示している。
このiPICの生着の再現性を確認するために、同じ細胞数のiPICを一頭の糖尿病ミニブタの腹膜前腔と、別の糖尿病ミニブタ腹部皮下部位に移植した。そして、いずれの移植でも血漿中ヒトCペプチドを検出できた。
iPS細胞由来膵島細胞の生着とインスリンを分泌を確認
「今回の研究で、作製した免疫抑制糖尿病ミニブタを用いて異種の膵島移植の検討が可能であることが示された」と、研究者は述べている。
「動物実験用のミニブタに対して、脾臓・胸腺の摘出、膵β細胞の除去などにより安定的な糖尿病症状を誘導し、さらに免疫抑制剤を投与し、異種の膵島移植が可能な糖尿病モデルのミニブタを作製できることを示した。また、ヒトiPS細胞から作製した膵島様細胞をこの糖尿病ミニブタに移植すると、組織中に生着し、インスリン分泌機能を発揮することが示された」としている。
モデル作製に用いたミニブタは、ヒトに近い解剖学的特性をもつことから、今後、糖尿病に対するヒト細胞を用いた細胞移植治療の開発に対して、臨床で想定されるサイズの移植物およびその移植手術手技の検討に役立つと期待さるとしている。
京都大学iPS細胞研究所(CiRA)
Xenogenic Engraftment of Human-Induced Pluripotent Stem Cell–Derived Pancreatic Islet Cells in an Immunosuppressive Diabetic Göttingen Mini-Pig Model (Cell Transplantation 2024年10月14日)