細胞がグルコース代謝量を制御する巧妙な仕組みを解明 細胞中のATP濃度に依存した酵素活性の制御機構 理研
酵素による代謝制御の新たな仕組みを解明 解糖系の働きがATP合成を巧みに調節
理化学研究所は、グルコースからアデノシン三リン酸(ATP)を合成する解糖系酵素のひとつであるホスホグリセリン酸キナーゼ(PGK)が、細胞内ATP濃度に応じてブドウ糖(グルコース)代謝量(解糖流量)を制御していることを発見した。
食事で得られるもっとも基本的なエネルギー源のブドウ糖(グルコース)は、「解糖系」という10ステップの酵素反応が連なる糖の代謝経路によりピルビン酸に分解され、その過程でエネルギー通貨とも呼ばれるアデノシン三リン酸(ATP)が合成される。ピルビン酸はさらに、ミトコンドリア内にあるクエン酸回路に運ばれ、酸素呼吸によるATP合成に使われる。
一方、細胞が酸素を利用できない条件では、ピルビン酸はミトコンドリアには運ばれず、細胞質内で乳酸に代謝される。この場合、酸素呼吸によるATP合成ができないため、代わりに解糖系が活発に働き、細胞のATP合成の多くを解糖系がまかなうことになる。
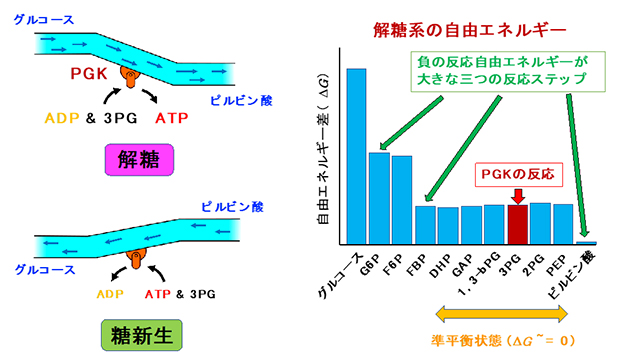
細胞は、細胞内外の状態変化によって解糖系の活性状態を変化させ、グルコース代謝量(解糖流量)をコントロールしている。解糖系の活性状態はこれまで、一連の酵素反応のうち反応が自発的に進むステップでコントロールされると考えられていたが、最近、反応が進みにくい(反応が準平衡状態にある)ステップも、解糖流量の調節に関与し得ることを示唆する報告が出てきた。
そこで研究チームは、ATP合成が準平衡状態にある反応を担う酵素PGKに着目し、生理的条件での解析が可能な核磁気共鳴(NMR)法を用いて、PGKの反応制御機構を解析した。
その結果、PGKは細胞内のATPの濃度を感知しながら、基質である3-ホスホグリセリン酸(3PG)との結合親和性を変化させることで、ATPの合成を巧みに調節していることが明らかになった。

研究で解明されたPGKによる解糖流量の制御の仕組みは、準平衡状態の反応で、基質結合協同性の非常に小さな結合自由エネルギー差の違いがもたらすものだった。このような基質結合協同性を利用した制御機構は、エネルギー変化が小さいがゆえに、基質の合成・分解の両方向への反応を触媒する酵素が特有にもつ、タンパク質レベルでの反応制御機構と考えられるという。
これは、遺伝子レベルでの酵素量の増減による制御と異なり、細胞の状態変化に素早く対応できるため、外部環境変化に迅速に対応するために備わった細胞の防御システムのひとつである可能性がある。解糖系以外の代謝系でもこのような制御が働いているか、さらなる検証が期待されるとしている。
研究は、理化学研究所生命機能科学研究センター細胞構造生物学研究チームの八木宏昌研究員、葛西卓磨研究員、木川隆則チームリーダーらの研究チームによるもの。研究成果は、科学誌「Proceedings of the National Academy of Sciences of the United States of America(PNAS)」にオンライン掲載される予定。
「代謝は私たちの日常生活と深く関わっています。代謝の乱れは、2型糖尿病や脂質異常症、メタボリックシンドロームなどの生活習慣病を誘発します。代謝制御機構の深い理解は、こうした生活習慣病の改善につながることも期待できます」と、研究グループでは述べている。
また、「解糖系の恒常的な活性化は、がん細胞特有の現象であることが知られており、特定のがん細胞ではPGKの発現量の増加がみられます。研究から、今後、がん細胞に特化した解糖系の活性化を調節する仕組みの理解が進むことで、新しい抗がん剤治療の開発の糸口になると期待されます」としている。
理化学研究所生命機能科学研究センター細胞構造生物学研究チーム
Molecular mechanism of glycolytic flux control intrinsic to human phosphoglycerate kinase(Proceedings of the National Academy of Sciences of the United States of America (PNAS))
10.1073/pnas.2112986118











