週1回投与のGIP/GLP-1受容体作動薬「Tirzepatide」 心血管リスクの高い成人2型糖尿病患者対象の第3相試験で主要項目・副次項目を達成
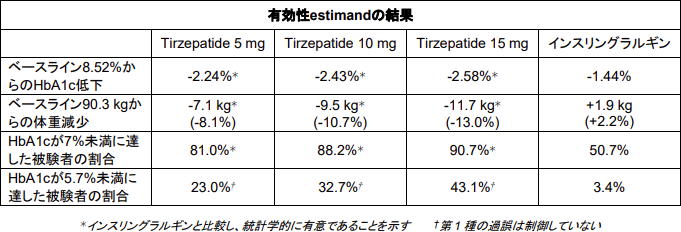
有効性estimandの評価から、52週時のインスリングラルギンの結果(HbA1c 1.44%低下、体重1.9kg(2.2%)増加)に対し、Tirzepatide最高用量群(15mg)では、HbA1cが2.58%低下し、体重が11.7kg(13.0%)減少した。

GIPとGLP-1の両インクレチンの作用を統合した週1回投与デュアルGIP/GLP-1受容体作動薬
イーライリリー・アンド・カンパニーは、心血管イベントの発症リスクの高い成人2型糖尿病患者を対象とした第3相臨床試験「SURPASS-4試験」のトップライン結果から、ベースラインからのHbA1c低下および体重減少について、「Tirzepatide」の3用量(5mg、10mg、15mg)全群にわたり、インスリングラルギン漸増投与群に対する優越性が示されたことを公表した。
同社が開発中のTirzepatideは、GIPとGLP-1の両インクレチンの作用を単一分子に統合した週1回投与デュアルGIP/GLP-1受容体作動薬。GIPは、GLP-1受容体作動薬の効果を補完するホルモンだ。
前臨床モデルで、GIPは食物摂取量を減少させエネルギー消費を増加させることが示されているため、体重の減少をもたらすと考えられる。また、GLP-1受容体作動薬と併用することでグルコースと体重に対してより大きな効果をもたらす可能性がある。
同剤は、成人2型糖尿病患者の血糖値管理と慢性的体重管理のために第3相で開発中。また、非アルコール性脂肪肝炎(NASH)および左室駆出率の保たれた心不全(HFpEF)の治療薬としても研究されている。
「SURPASS-4試験」は、心血管イベント発症リスクが高く、1~3種類の経口血糖降下薬(メトホルミン、スルホニルウレア系薬剤またはSGLT2阻害剤)による治療を受けている2,000人以上の2型糖尿病患者を対象に、Tirzepatideの3つの用量(5mg、10mg、15mg)の安全性と有効性をインスリングラルギン漸増投与と比較した非盲検国際共同試験。
同試験の終了タイミングは、規制当局の申請要件である2型糖尿病治療薬の心血管リスクを評価するために必要な、主要心血管イベント(MACE)のデータ収集状況により決定された。主要評価項目は52週時に測定されたが、多くの被験者は52週以降も治療を継続し、なかには最長2年におよぶ被験者もいた。
あらかじめ定めた数の主要心血管イベントが発症した時点で、SURPASS臨床試験プログラム全体の心血管安全性のメタ解析が行われた。メタ解析の対象となったのは、複合エンドポイント(心血管死または原因不明の死亡、心筋梗塞、脳卒中および不安定狭心症による入院)であるMACE-4と判定された116名の被験者だった。
被験者の糖尿病の罹病期間は平均11.8年、ベースラインのHbA1cは8.52%、ベースラインの体重は90.3kgだった。85%以上の被験者が心血管イベントの既往を有していた。インスリングラルギン投与群では、空腹時血糖値が100mg/dL未満に到達することを目標に、treat-to-targetの治療アルゴリズムに従いインスリン投与量を漸増した。インスリングラルギンの開始用量は1日10単位、52週時の平均投与量は1日43単位だった。
最高用量群では、91%がHbA1c 7%未満に、43%はHbA1c 5.7%未満に到達
その結果、同試験で主要評価項目および主な副次評価項目を達成したことが示された。有効性estimand*1および治療方針estimand*2を用いたいずれの評価でも、Tirzepatideの3用量(5mg、10mg、15mg)全群にわたり、インスリングラルギンに対するHbA1c低下および体重減少の優越性が示された。
同剤最高用量群(15mg)では、91%の被験者がHbA1c 7%未満(米国糖尿病学会が糖尿病患者に推奨する目標)に到達し、43%の被験者は糖尿病ではない人のレベルである5.7%未満のHbA1cに到達した。
52週時の詳細な結果は以下の通り――。
治療方針estimandの評価で、Tirzepatideの3用量(5mg、10mg、15mg)全群にわたり、インスリングラルギンに対するHbA1c低下および体重減少の優越性が示された。詳細な結果は以下の通り――。
⚫ HbA1c低下:-2.11%(5mg)、-2.30%(10mg)、-2.41%(15mg)、-1.39%(インスリングラルギン)
⚫ 体重変化:-6.4kg(5mg)、-8.9kg(10mg)、-10.6kg(15mg)、+1.7kg(インスリングラルギン)
⚫ HbA1cが7%未満:75.1%(5mg)、82.9%(10mg)、84.9%(15mg)、48.8%(インスリングラルギン)
同剤の全体的な安全性プロファイルは、これまでに確立されたGLP-1受容体作動薬の薬剤クラスの患者集団と同様だった。もっとも多く報告された有害事象は消化器関連であり、通常、投与量の増量期間中に認められ、時間の経過とともに減少した。
52週時における54mg/dL未満の低血糖は、Tirzepatide投与群で6.7%(5mg)、5.5%(10mg)、6.5%(15mg)の被験者に、インスリングラルギン群で15.0%に認められた。低血糖の発現は、スルホニルウレア系薬剤を基礎治療として使用していた被験者により多く認められた。
Tirzepatide群で52週時にもっとも多く報告された有害事象は消化器関連であり、概して軽度から中等度だった。同試験のTirzepatide投与群(それぞれ5mg、10mg、15mgの順)では、 悪心(11.9%、15.9%、22.2%)、下痢(12.2%、19.5%、20.4%)、嘔吐(4.9%、8.2%、8.3%)がインスリングラルギン投与群(悪心1.6%、下痢3.2%、嘔吐1.1%)に比べて多く認められた。
52週時における有害事象に起因する治療中止割合は、8.2%(5mg)、7.3%(10mg)、8.9%(15mg)、2.9%(インスリングラルギン)だった。
ギリシャ・アテネのIatriko Paleou Falirou Medical Centerの糖尿病診療科長およびセンター長であり、SURPASS-4試験の治験責任医師であるJohn Doupis氏は次のように述べている。
「本試験の優れた結果から、Tirzepatideはインスリングラルギンに対し、心血管イベント発症リスクの高い2型糖尿病患者さんのHbA1c低下に優越性を示すだけでなく、有意な体重減少も示しました。2型糖尿病は複雑な疾患であり、個々の患者さんに合わせた治療法が必要です。SURPASS-4試験の結果は、1~3種類までの経口血糖降下薬を服用している2型糖尿病患者さんのHbA1c低下と体重減少を助ける有力な選択肢となる可能性を示しています」。
SURPASSプログラムは同試験結果により、米食品医薬品局(FDA)への申請要件である心血管イベントのリスク評価を満たしたため、同社は2021年の年末までに、規制当局へ申請データパッケージを提出する予定としている。










