肥満状態では肝臓などの血糖制御ネットワークの変化は広範に及ぶ 血糖恒常性の破綻である2型糖尿病のメカニズムを解明
2020.12.16
東京大学大学院理学系研究科などの研究グループは、グルコース投与という摂食に近い条件下で、肝臓がいかに代謝制御を行うかをはじめて大規模に明らかにしたと発表した。
代謝経路情報を用いたトランスオミクスネットワークの縮約手法を開発し解析したところ、血糖値の恒常性は、肝臓のみならず全身の臓器連関ネットワークを介して維持されていることが分かった。
代謝経路情報を用いたトランスオミクスネットワークの縮約手法を開発し解析したところ、血糖値の恒常性は、肝臓のみならず全身の臓器連関ネットワークを介して維持されていることが分かった。

血糖値の恒常性は、肝臓などの臓器連関ネットワークを介して維持されている
東京大学大学院理学系研究科などの研究グループは、グルコース投与という摂食に近い条件下で、肝臓がいかに代謝制御を行うかをはじめて大規模に明らかにしたと発表した。 この制御システムに対して肥満が及ぼす影響も評価し、このシステムの代謝物による制御の消失や遅い遺伝子発現を介した制御など、肥満における代謝制御の新たな側面も明らかにした。 血糖値の恒常性は、肝臓のみならず全身の臓器連関ネットワークを介して維持されているため、他の代謝臓器にもこの解析手法を拡張していくことで、2型糖尿病など血糖恒常性の破綻メカニズムの全容が明らかとなると考えられるとしている。 研究は、小鍛治俊也氏(東京大学大学院理学系研究科生物科学専攻 特任助教)、幡野敦氏(新潟大学大学院医歯学総合研究科 助教)、伊藤有紀氏(九州大学生体防御医学研究所 特別研究員)、黒田真也氏(生物科学専攻 教授)らによるもの。研究成果は、科学誌「Science Signaling」に掲載された。肥満状態における血糖制御ネットワークの変化は非常に広範に及ぶ
グルコースは最も重要な栄養源の1つであるため、人体には血液中のグルコース濃度(血糖値)を一定に保つ制御ネットワークが備わっている。 たとえば、食事などで一時的に血糖値が上昇すると、血糖値を下げるホルモンであるインスリンの作用などで、肝臓や筋肉などでグルコースに関与するさまざまな代謝系が調節され、結果として血糖値は元の正常値まで速やかに下降する。 一方で、肥満にともない血糖の制御ネットワークは正常に機能しなくなり、2型糖尿病になりやすくなることが知られている。しかし、グルコースに関与する代謝系は多種多様であるため、肥満による血糖制御ネットワークの機能不全がどのようにして起こるかは不明だった。 そこで研究グループは、健常マウスと肥満マウスの肝臓でグルコース投与により発現が変化する遺伝子、物質量が変化する代謝物を網羅的に同定し、これらを統合することで大規模代謝制御ネットワーク(トランスオミクスネットワーク)を構築した。 このネットワークを健常マウスと肥満マウス間で比較することで、肥満による代謝制御不全を大規模に明らかにした。 これにより、健常マウスではインスリンによる遺伝子発現を介した代謝制御に加え、代謝物自身による代謝制御が投与後20分程度で多くみられることや、肥満マウスでは代謝物自身による代謝制御の多くが失われ、投与後1時間後から遺伝子発現による代謝制御が糖代謝・脂質代謝などで活性化されることが見出された。 このことは、健常状態と肥満状態における血糖制御ネットワークの変化は非常に広範に及ぶことを示している。2型糖尿病など血糖恒常性の破綻メカニズムの全容を明らかに
さらに、健常マウスの代謝はAkt経路を介した遺伝子発現と代謝物自身により速く制御され、一方肥満マウスでは速い代謝制御の多くが失われ、遺伝子発現による遅い代謝制御が糖代謝・脂質代謝などで活性化することを見出した。 健常マウスと肥満モデルマウスであるob/obマウスに対して、グルコースを投与し、トランスクリプトーム解析とメタボローム解析により、臓内でのRNA量と代謝物量の時系列測定を行った。 これらの大規模データからグルコース投与に対して増加もしくは減少する代謝酵素遺伝子、代謝物を同定した。同定した代謝酵素遺伝子に対して塩基配列を用いた手法により、グルコース応答関連転写因子を推定した。 またインスリンシグナル経路を個別解析し、転写因子を制御するインスリンシグナル分子を同定した。最後に、制御経路データベースを用いてグルコース応答性の代謝酵素遺伝子及び代謝物により制御される代謝酵素を同定し、グルコース投与時の代謝制御ネットワークを構築した。 この制御ネットワークを健常マウスと肥満マウス間で比較することにより、健常マウスに特異的な制御経路や肥満マウスに特異的な制御経路を大規模に明らかにした。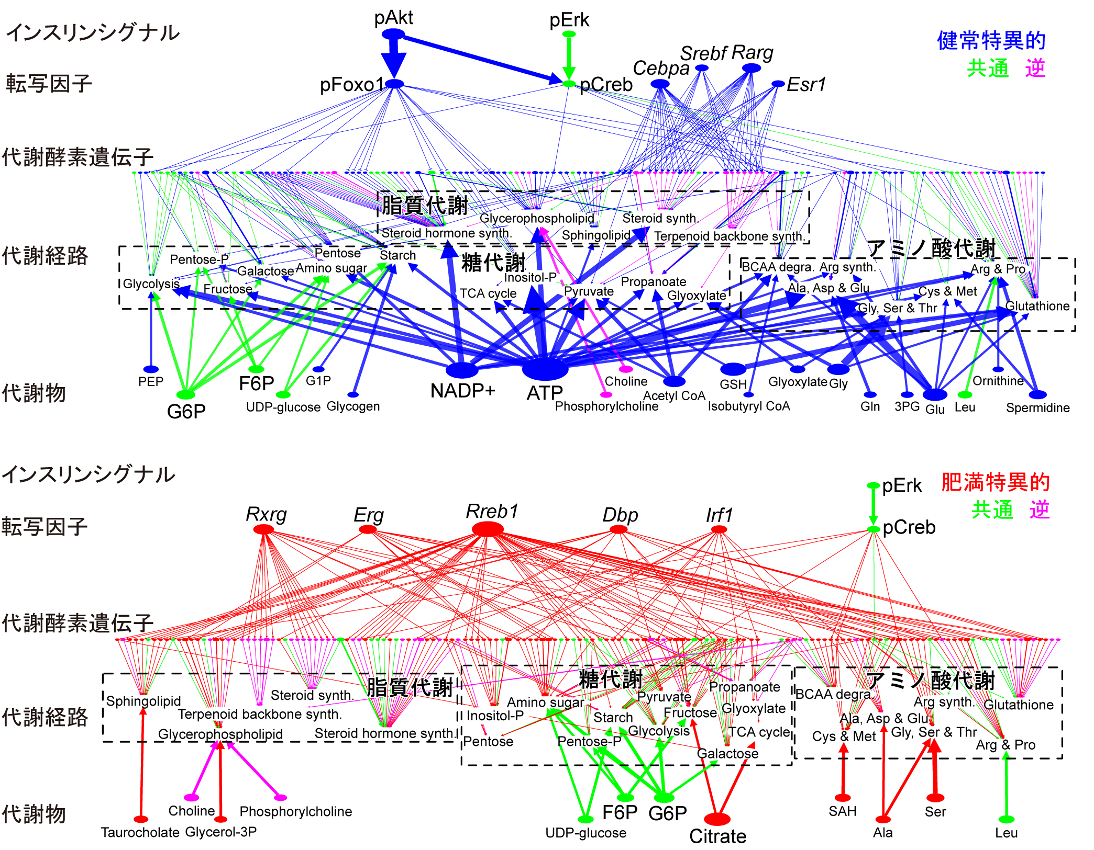
代謝酵素層の分子を代謝経路ごとにまとめなおし、代謝経路層を構築している。ここでは、糖代謝・脂質代謝・アミノ酸代謝に含まれる代謝経路のみに絞っている。
出典:東京大学大学院理学系研究科・理学部、2020年
健常マウスと比べて肥満マウスの縮約ネットワークからは、(i)インスリンシグナル層からの代謝制御のうち、Akt制御経路が失われるが、Erk制御経路は保たれること、(ii)代謝酵素遺伝子による代謝経路制御は脂質代謝でやや減少し、糖・アミノ酸代謝でやや増加すること、(iii)数少ないマウス間で共通する代謝物による制御には、解糖系上流代謝物G6PおよびF6Pによる糖代謝制御が含まれること、などの特徴を見出した。
肥満マウスにおけるトランスオミクスネットワークのグルコースに対する応答を明らかにすることは、血糖恒常性の破綻である2型糖尿病のメカニズム解明に役立つと考えられる。
東京大学大学院理学系研究科・理学部Trans-omic analysis reveals allosteric and gene regulation-axes for altered glucose-responsive liver metabolism associated with obesity(Science Signaling 2020年12月1日)
[Terahata / 日本医療・健康情報研究所]











