低炭水化物食による減量メカニズムを解明 ケトン体の新たな受容体を発見 腸内環境の変化も重要
2019.11.07
東京農工大学は、低炭水化物食などがもたらす体脂肪重量の効率的な減少効果に、飢餓のようなエネルギー不足時にグルコースの代替エネルギー源として産生されるケトン体の一種であるアセト酢酸とその受容体、さらに腸内環境の変化が密接に関わっていることを明らかにしたと発表した。

ケトン体による作用機序には不明な部分が多い
ケトン体とその受容体を介した分子栄養メカニズムの解明は、栄養管理による予防医学、さらにはケトン体受容体を標的とした代謝性疾患治療薬の開発につながる可能性がある。 研究は、東京農工大学大学院農学研究院応用生命化学部門の木村郁夫教授らの研究グループが、慶應義塾大学、京都医療センターと共同で行ったもの。研究成果は、米国科学アカデミー紀要(PNAS)に掲載された。 ケトン体(主にβ-ヒドロキシ酪酸とアセト酢酸)は、飢餓時のようなグルコースが枯渇した状態において肝臓で産生され、速やかに脳や他の組織でグルコースの代わりに利用される。 このうち、β-ヒドロキシ酪酸は単なるエネルギー源としてだけではなく、Gタンパク質共役型受容体であるGPR109AやGPR41を介してシグナル分子として生体生理機能にまで関わることを、研究グループはこれまでに明らかにしている。 一方で、アセト酢酸の特異的な受容体は発見されていなかった。また、低炭水化物食や中鎖脂肪酸食のようなケトン体産生が誘導されるケトン食などは、寿命の延伸、効率的な減量効果や脳機能改善など、健康に寄与することがマウス実験から期待されているが、ケトン体による作用機序には不明な部分が多かった。ケトジェニック環境下では全身のエネルギー利用が亢進
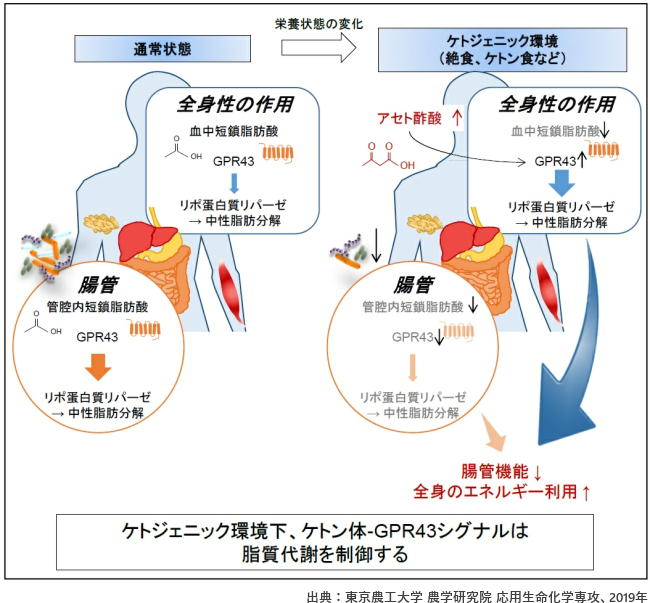
そこで研究グループは、モノカルボン酸リガンドスクリーニングにより、Gタンパク質共役型受容体のひとつGPR43が、アセト酢酸の受容体であることを新たに発見した。 本来GPR43は、短鎖脂肪酸により活性化される受容体として知られており、生体のエネルギー代謝や免疫機能に重要な役割を果たしている。 この短鎖脂肪酸は、食事中に含まれる食物繊維などの難消化性多糖類から腸内細菌発酵によって作られる主要代謝物であることから、短鎖脂肪酸受容体GPR43は腸内細菌と宿主をつなぐ重要な受容体と考えられてきた。 さらに研究グループは、生体内でケトン体が上昇しているケトジェニックの環境下、ケトン体であるアセト酢酸によるGPR43刺激が、血中のリポ蛋白質リパーゼの活性を高めることで中性脂肪の分解を促進し、効率的に脂肪酸を組織に取り込む結果、脂質の利用を高める、すなわち脂肪の消費を優先的に進めることを明らかにした。 通常の状態では、GPR43は腸内細菌が食事に含まれる食物繊維を分解して産生する短鎖脂肪酸によって、腸管および血中を介して全身で活性化されている。これが、栄養状態の変化、すなわち低炭水化物食や断続的断食を行うことで、腸内細菌叢が変化し、腸内細菌により短鎖脂肪酸の産生が腸管内では著しく減少することを発見。低炭水化物により腸内環境が変化
アセト酢酸がGPR43を介して脂質代謝を制御
Ketone body receptor GPR43 regulates lipid metabolism under ketogenic conditions(米国科学アカデミー紀要(PNAS) 11月4日)
[Terahata / 日本医療・健康情報研究所]











