肥満を制御する酵素を発見 L-PGDSが肥満やインスリン抵抗性を進展 東大
2019.02.15
東京大学、大阪薬科大学、第一薬科大学、筑波大学の研究グループは、脂質のひとつである「プロスタグランジンD2(PGD2)」とPGD2のL型合成酵素「L-PGDS」が、肥満やインスリン抵抗性を進展させる働きをしていることを確かめた。
L-PGDSの働きを抑える化合物を開発できれば、新たな抗肥満薬を開発できる可能性がある。
L-PGDSの働きを抑える化合物を開発できれば、新たな抗肥満薬を開発できる可能性がある。
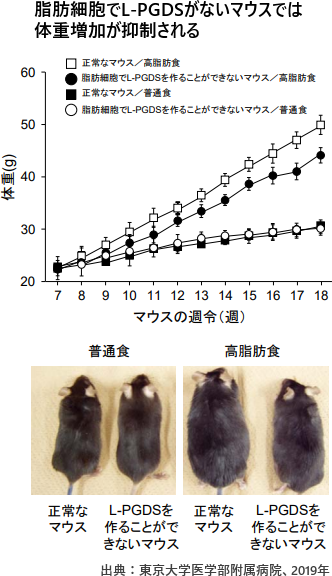
L-PGDSが肥満やインスリン抵抗性を進展させる
研究は、東京大学医学部附属病院眼科の裏出良博特任研究員、大阪薬科大学薬学部病態生化学研究室の藤森功教授らによるもので、詳細は科学誌「Scientific Reports」オンライン版に掲載された。 肥満は2型糖尿病(インスリン抵抗性糖尿病)や脂質異常症などの原因になる。肥満は複雑に制御されており、新たな抗肥満薬の開発につながる「肥満調節分子」の発見が期待されている。 肥満では、体の組織に脂質が蓄積するだけでなく、脂質自体が直接、肥満などの病態の進展に関わる。 研究グループはこれまでに、脂質のひとつである「プロスタグランジンD2(PGD2)」とPGD2のL型合成酵素「L-PGDS」が脂肪細胞に蓄積した脂肪の分解の抑制に関わることを発見していた。 プロスタグランジン(PG)は炭素数20個からなる生理活性脂質。これと化学構造の異なるPGD2は、これまでに睡眠の誘発やアレルギーの増悪化などの作用を有することが知られている。また、L型酵素は脳、心臓、脂肪組織などに分布して、睡眠や動脈硬化、脂質代謝に関与する。 今回の研究で、肥満制御におけるPGD2の働きを調べるため、脂肪細胞でL-PGDSを作ることができないマウスを作製し、肥満におけるL-PGDSの働きを解析した。 正常なマウスと脂肪細胞でL-PGDSを作ることができないマウスに11週間、高脂肪食を与えて肥満にさせたところ、脂肪細胞でL-PGDSを作ることができないマウスでは、正常なマウスと比べて体重増加が20%以上減少し、 内臓や皮下の脂肪量も減少した。 肥満の脂肪組織にはマクロファージが浸潤し、炎症状態になることが知られているが、脂肪細胞でL-PGDSを作ることができないマウスでは、炎症を誘導するマクロファージのマーカー遺伝子であるF4/80やCD11cの発現レベルが低下しており、糖尿病の指標となるインスリン感受性も改善することが分かった。 また、脂肪細胞の分化の程度を測るためのマーカー遺伝子や脂肪酸の生合成に関わる多くの遺伝子の発現も低下。さらには、血液中のコレステロール、脂質、グルコース値も、正常マウスと比べて、低下していることなども確認。 L-PGDSの働きを抑える化合物を開発できれば、新たな抗肥満薬を開発できる可能性がある。 東京大学医学部附属病院L-PGDS-produced PGD in premature, but not in mature, adipocytes increases obesity and insulin resistance(Scientific Reports 2019年2月13日)
[Terahata / 日本医療・健康情報研究所]












