薬の効き具合を早く予測 核磁気共鳴装置を利用
2012.10.06
東京大学は、核磁気共鳴装置(NMR)を用いて薬の効き具合を正確に予測する手法を開発したことを発表した。膜タンパク質のNMRシグナル変位を観測することによって薬効を予測するもので、無数の物質から薬の候補物質を見つけ出す際の動物実験などで調べる従来の方法と比べ、薬の候補物質探索を大幅に効率化することができるようになるという。
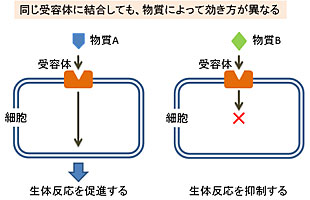
成果は、東大大学院 薬学系研究科の嶋田一夫教授らの研究グループによるもの。研究の詳細な内容は、9月4日付けで英国科学誌「Nature Communications」に掲載された。 ヒトをはじめ多くの生命体の細胞膜上には、細胞外からのシグナルを細胞内に伝える役割を持つ「受容体」と呼ばれる膜タンパク質が多数存在し、外部環境を感知して細胞内に伝え、さまざまな生命活動を維持している。 中でも「Gタンパク質共役型受容体(GPCR)」と呼ばれる膜タンパク質にはシグナルごとに多種多様なものが存在する。これまでに開発された医薬品のうち、およそ半数は受容体に作用する薬剤であり、そのほとんどがGPCRであることが分かっている。GPCRはもっとも医薬品に結びつきやすいとみられており、糖尿病、肥満などにおいて重要な薬剤ターゲットとなっている。 これまでにも、このGPCRの機能を高めたり阻害したりする物質が探索されて医薬品が作られてきた。例えば、膵島β細胞表面に発現するGPCRであるGPRは、グルコースに依存してインスリン分泌を促進する。これまでにもいくつかのGPRアゴニストが、高血糖状態においてのみ用量依存的なインスリン分泌作用を示すことが報告されており、糖尿病治療薬としての開発が進められている化合物もある。 しかし、同一のGPCRに結合する医薬品であっても、その効果の程度に差があったり、まったく逆の作用を示すものがあり、なぜこのような現象が起きるのか、その機構は不明のままだった。 したがって、これまでのGPCRを標的とした医薬品探索においては、カギとカギ穴のような関係でGPCRに結合する物質を探索することから始まり(スクリーニング)、その後は研究者の経験と勘に頼る形で目的の効果を持つ化合物に修飾していくため、その成功確率は低く、医薬品候補物質を見出すまでには多大な時間と労力を要していた。 そうした状況において嶋田教授らは今回、NMRを用いた解析手法を開発して、「リガンド(受容体結合分子)」によるGPCRの機能調節の仕組みを突き止めることに成功した。 GPCRの立体構造には「活性型」と「不活性型」が存在し、生体内ではそれらの立体構造が共存して、互いに行き来する「動的平衡状態」にあることが明らかになった。 さらにリガンドがGPCRに結合すると、この活性型と不活性型の存在比率に偏りが生じ、その結果としてGPCRの機能が調節されることも確認された。この活性型と不活性型の存在比率の偏りの度合いが、結合したリガンドの種類によって異なるため、これがリガンドごとに効果が異なる要因であることもあきらかになった。 今回開発されたNMR解析手法を医薬品開発の初期段階に導入することにより、研究者の経験と勘に頼らず、さらには細胞実験もしくは動物実験を必要とせずに、リガンドとなる医薬品候補化合物の効果を予測することが可能になるため、医薬品開発が加速されることが期待されるという。 NEDO:独立行政法人 新エネルギー・産業技術総合開発機構
[dm-rg.net / 日本医療・健康情報研究所]











