新型コロナの持続感染は心不全リスクを高める ポストコロナの「心不全パンデミック」に警戒
ポストコロナの「心不全パンデミック」が懸念されている
新型コロナは、流行初期に比べて変異株の重症化率が低下していることや、ワクチン接種、治療薬の開発などを経て、現在の状況は「ポストコロナ」に移行し、医療対策は急性期の症状だけではなく、慢性的な健康問題にも焦点があてられるようになった。
一方で、ポストコロナでは、将来に新型コロナウイルスの持続感染を素因とする「心不全パンデミック」に発展する可能性があることが懸念されている。
新型コロナウイルスは、アンジオテンシン変換酵素2(ACE2)を介して細胞に感染する。心臓でのACE2の発現は、他の臓器に比べて高く、さらに心不全患者では、心筋細胞でのACE2の発現が健常対照者よりも高いことが報告されている。このことから、疾患状態の心臓は、新型コロナウイルスに感染しやすい可能性がある。
また、新型コロナが流行する10年以上前に行われた研究では、特発性慢性心筋症患者の心内膜生検から、ウイルスゲノムが検出されたことや、慢性的なウイルス感染が心機能を低下させることが報告されている。
これらを総合的にみると、今回の新型コロナのパンデミックにより、今後、新型コロナウイルスの持続感染を素因とする心不全リスク人口が、指数関数的に増加する「心不全パンデミック」の発生が危惧されるとしている。
新型コロナ感染が持続しながら表面的には心機能が維持されている患者群が存在
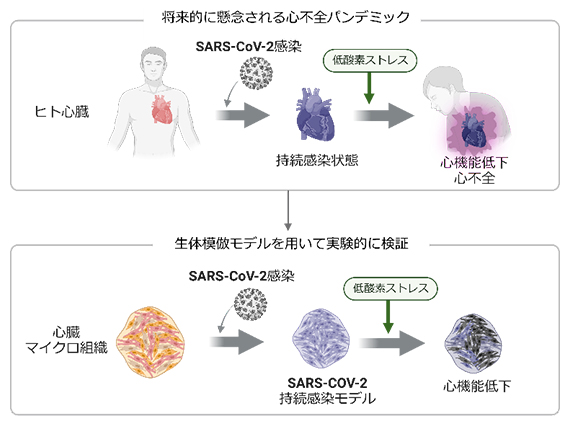
研究グループは今回、新型コロナウイルスの心臓への持続感染の可能性と、心不全の日和見的進行の潜在リスクについて、ヒトiPS細胞を用いた心臓マイクロ組織により検証した。心臓に無症状で持続感染している新型コロナウイルスが、心臓への追加ストレスなどをきっかけに、心不全心をまねくことを日和見的進行とした。
まず、ヒトiPS細胞由来の心臓マイクロ組織(CMT)を用いて、ヒト心臓の新型コロナウイルス持続感染モデルを作製した。CMTは、ヒトiPS細胞から分化した心筋細胞、およびその他の心臓構成細胞(血管内皮細胞、血管壁細胞など)で構成され、実際の心臓のように拍動する。また、血管網様構造をもつことが特徴で、形態的・機能的にヒトの心臓を模倣したものだ。
新型コロナの症状には、無症状から重症まで広い幅がある。そこで、CMTに新型コロナウイルスをさまざまな力価で感染させて影響を調べたところ、感染後7日目までにすべての例で心機能(組織の収縮力)の低下がみられた。
その後、低力価群では、4週間後に心機能が回復傾向を示したが、高力価群では回復することなく、収縮力は低下したままだった。この高力価での感染モデルは、新型コロナの臨床症状のひとつである重篤な急性心疾患を反映している可能性がある。
一方、低力価での感染がCMTに与える影響を詳しく調べたところ、心筋細胞に新型コロナウイルス由来のスパイクタンパク質の局在が認められたが、心筋細胞のアポトーシスは、新型コロナウイルスに感染していない組織と同レベルであり、心筋細胞の構造も維持されていた。
しかし、組織外に放出された新型コロナウイルスの力価を測定すると、4週間後も感染直後のウイルス力価と同等の力価を示したことから、CMTに持続感染している新型コロナウイルスは増殖能を保持していることが示唆された。
新型コロナ持続感染では追加の心臓ストレスにより心機能障害や心不全を発症する危険性が
これらの結果は、新型コロナウイルスは軽度の感染であれば、機能障害を引き起こすことなく心筋組織に持続感染できることを示している。すなわち、新型コロナウイルス感染が持続しながらも、心不全を発症せず、表面的には心機能が維持されている患者群が存在している可能性がある。
研究グループは、低力価で感染したCMTを「新型コロナウイルス持続感染モデル」とみなし、「持続感染の確立した患者は心不全の限界リスクにあり、追加の心臓ストレスによって日和見的に心機能障害、最終的には心不全を発症する可能性がある」という仮説を立て検証した。追加の心臓ストレスの例としては、臨床的には虚血などにより心臓が一時的な低酸素状態にさらされることが考えられるとしている。
虚血性心疾患を模倣した低酸素ストレスに正常なCMTをさらすと、一定期間後に拍動数が上昇し収縮機能の回復がみられた。しかし、持続感染モデルでは、拍動数の上昇および収縮機能の回復は認められなかった。また、低酸素ストレスにより心筋細胞でのACE2の発現、および新型コロナウイルススパイクタンパク質と心筋細胞の共局在が促進していたことから、細胞内で新型コロナウイルスの再活性化が起こっていることが示唆された。
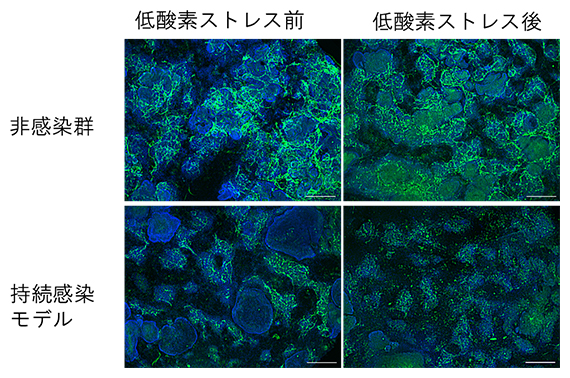
さらに特筆すべきこととして、非感染CMTでは、低酸素ストレス後でも血管網様構造が維持されているのに対し、持続感染モデルでは、低酸素ストレス後に血管網様構造が全体的に分断されていた。低酸素ストレス後に再活性化したSARS-COV-2は、近隣の内皮細胞へ感染を広げ、血管網様構造の維持を困難にした可能性が考えられるという。
これらの結果は、新型コロナウイルスの持続感染下にある心臓組織が追加の低酸素ストレスを受けた場合、新型コロナウイルスの細胞内再活性化が起こり、心機能低下および血管網の損傷を招く可能性があることを示している。
血管内皮細胞マーカー(緑色:CD31)で示される血管網様構造が、低酸素ストレス後の持続感染モデルでは消失している。
ポストコロナの「心不全パンデミック」は警戒すべきヘルスケア上の課題に
研究は、理化学研究所 生命機能科学研究センター 老化分子生物学研究チームの村田梢研究員(臨床橋渡しプログラム・升本研究室 研究員)、升本英利上級研究員(同研究室研究リーダー、京都大学 医学附属病院 心臓血管外科 特定准教授)、京都大学 医生物学研究所 ウイルス感染研究部門の朝長啓造教授、牧野晶子准教授らの共同研究グループによるもの。
「今回の研究成果から、新型コロナパンデミック後に起こりうる心不全パンデミックが、ポストコロナで警戒すべきヘルスケア上の課題のひとつであることが示された。このようなヘルスケアリスクへの対策として、研究で確立したCMTを用いた新型コロナウイルス持続感染モデルは、新型コロナウイルス心筋症の発症・進行メカニズムの解明および治療法の開発での有用な生体模倣モデルとなると期待できる」と、研究グループでは述べている。
新型コロナウイルス感染症の重篤化には、免疫系の異常であるサイトカインストームが関与していると考えられるという。しかし、今回の新型コロナウイルス持続感染モデルでは、低酸素ストレスによってもサイトカインストームを引き起こすサイトカインの上昇は観察されなかったため、新型コロナウイルス心筋症はサイトカインストームとは独立に生じている可能性がある。
一方で、このモデルではサイトカインに反応する免疫細胞そのものは含まれていないため、心臓以外の他臓器が関与する感染メカニズムが十分に再現できていない課題が残されている。
「現在、オルガノイド研究分野では、複数の臓器間相互作用まで考慮したモデル臓器の開発が進んでおり、将来的にこれらの研究成果を、今回の持続感染モデルに反映させることで、実際のヒト体内で起こっている現象をより忠実に再現できるようになると考えられる」と、研究グループでは述べている。
理化学研究所 生物機能科学研究センター 老化分子生物学研究チーム
京都大学 医生物学研究所 ウイルス感染研究部門
Predicted risk of heart failure pandemic due to persistent SARS-CoV-2 infection using a three-dimensional cardiac model (iScience 2023年12月22日)











