腸内細菌によるオメガ3脂肪酸代謝物が糖尿病やアレルギー性皮膚炎を抑制 ポストバイオティクスで腸内細菌の働きを解明
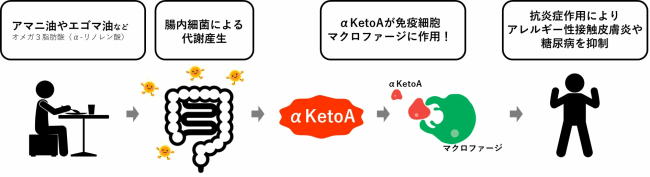
α-リノレン酸が腸内細菌による代謝により「αKetoA」に変換 強力な抗炎症活性が
研究は、医薬基盤・健康・栄養研究所ワクチン・アジュバント研究センターの國澤純センター長、同長竹貴広主任研究員らによるもの。研究成果は、「Mucosal Immunology」にオンライン掲載された。
α-リノレン酸やエイコサペンタエン酸(EPA)、ドコサヘキサエン酸(DHA)などのオメガ3脂肪酸は、健康増進のためのサプリメントなどとして利用されているが、その効果には個人差があることが指摘されている。
また、近年、腸内細菌が健康に関与することが明らかになり、そのメカニズムのひとつとして、食品成分を基質として腸内細菌が産生する機能性代謝物(ポストバイオティクス)の作用に注目が集まっている。
食の効能を規定する因子として、腸内細菌の代謝に着眼することで、高度に個別化/層別化された栄養・医療の実現につながると期待されている。
研究グループは、アマニ油やエゴマ油に豊富に含まれるオメガ3脂肪酸であるα-リノレン酸が、腸内細菌による飽和化代謝を経て、「αKetoA(アルファケトエー)」に変換されることを見出した。
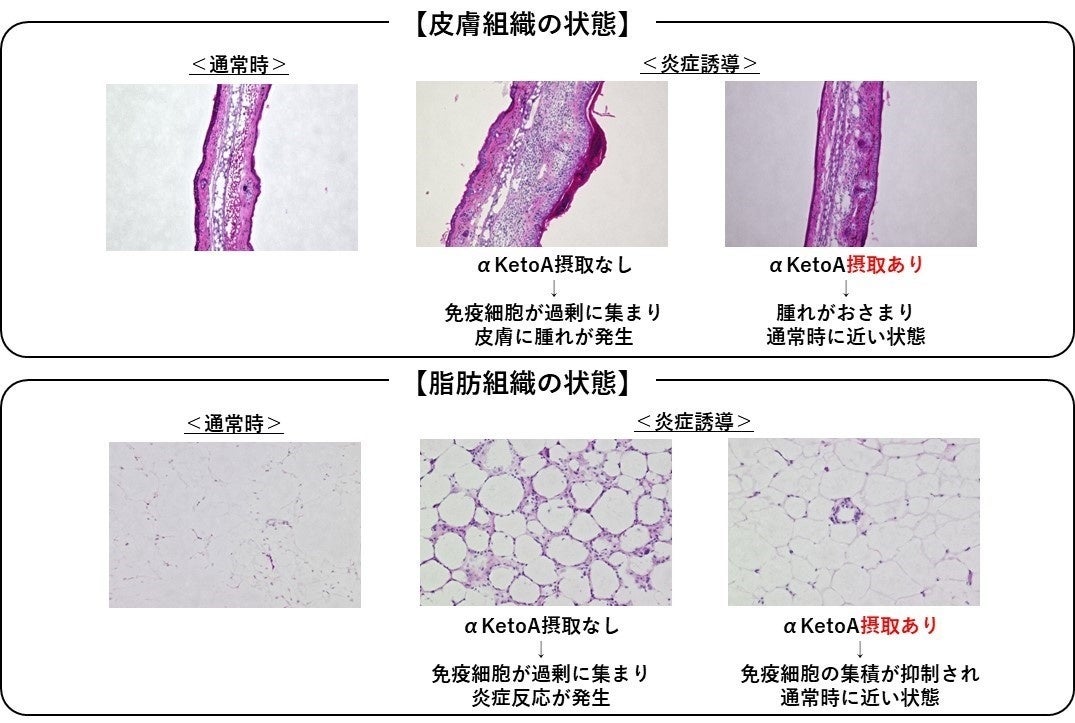
αKetoAの効能を検証した結果、強力な抗炎症活性があることが明らかになった。αKetoAは、免疫細胞のひとつであるマクロファージに作用して、アレルギー性接触皮膚炎を抑えることや、糖尿病の病態を改善することを動物モデルで確かめた。
とくに糖尿病については、今回の研究で用いた糖尿病モデルは、マウスに高脂肪・高糖質餌を与えることで得られた2型糖尿病モデル。一般的に生活習慣病と称されるタイプの2型糖尿病は、慢性的な炎症反応によりインスリンの作用が阻害されることが高血糖病態の形成に関与している。
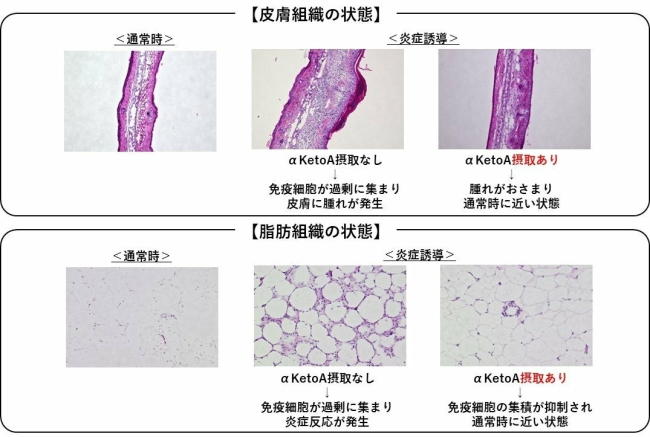
さらに、αKetoAの抗炎症作用の分子メカニズムとして、ペルオキシソーム増殖因子活性化受容体(PPARγ)に作用することも分かった。PPARγは、核内受容体の1種で、転写制御因子としてだけでなくシグナル伝達の制御にも働く。
αKetoAは、ヒト糞便中でも検出され、α-リノレン酸を多く摂取することで、αKetoAの産生量も増加した。一方で、αKetoAの産生量には個人差が認められ、腸内細菌叢が異なることが要因と考えられる。
「今回の研究によって、動物モデルとヒト検体で、αKetoAの存在が確認され、動物モデルにおいて炎症性疾患に対する有効性が見出されました。ヒトでの有効性は今後の検討課題です」と、研究グループでは述べている。
医薬基盤・健康・栄養研究所ワクチン・アジュバント研究センター
Intestinal microbe-dependent ω3 lipid metabolite αKetoA prevents inflammatory diseases in mice and cynomolgus macaques (Mucosal Immunology 2022年1月10日)