肥満を腸内細菌の栄養源となる2つの糖が抑制 腸内細菌利用糖によるプレバイオティクス開発に期待
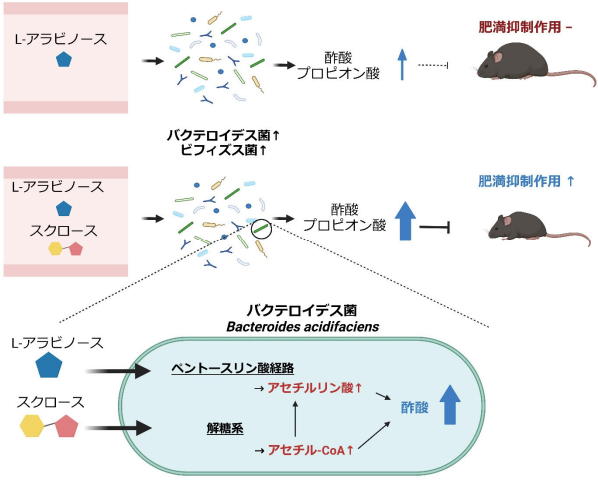
L-アラビノースとスクロースを同時に摂取すると高脂肪食負荷による肥満を抑制
食物繊維に代表される難消化性・難吸収性の糖類は、体内へ取り込まれずに腸内細菌の栄養源となることから、腸内細菌利用糖(MACs)と呼ばれている。MACsは腸内環境を改善し、健康維持や疾患予防に寄与することが知られている。
MACsには多様なものがあるが、それぞれのMACsの特性、それぞれの腸内細菌利用糖が腸内環境や宿主生理機能に与える影響の違いについては詳細な解析がされていない。
L-アラビノースは、トウモロコシや米・小麦などの穀物の繊維質に含まれる単糖で、小腸から吸収されにくい性質がある。また、L-アラビノースは、スクロース(ショ糖)の消化に関わるスクラーゼという酵素の活性を阻害することも知られている。
研究グループは今回、L-アラビノースとスクロースを同時に摂取すると、どちらもMACsとして機能し、特定の腸内細菌に協調的に作用することで、有益な腸内細菌代謝物として知られている短鎖脂肪酸である酢酸・プロピオン酸の産生を相乗的に促進させ、高脂肪食誘導性の肥満を抑制することを明らかにした。
短鎖脂肪酸は、腸内細菌により産生される有機酸。腸上皮細胞の増殖や粘液の分泌、多様な免疫細胞の機能制御、代謝機能制御、感染防御など多彩な機能をもつ。
腸内細菌利用糖は腸内環境改善の協調的・相乗的な作用を発揮
研究グループは、腸内細菌の酢酸産生で、L-アラビノースとスクロースが異なる代謝経路を活性化することも解明した。
スクロースを主成分とする砂糖は料理などに多用されているが、過剰摂取により肥満のリスクを高める。スクロースを多く含む食品とともにL-アラビノースを摂取すると、スクロースの消化・吸収が抑えられるだけでなく、2つの糖の協調作用により腸内環境も改善され、肥満を抑制できる可能性が示唆された。
腸内環境を改善する方法として、代表的なMACsである食物繊維を摂取することが挙げられるが、これまでそれぞれの腸内細菌利用糖のもつ機能の違いについては詳細に検証されていなかった。
研究により、複数のMACsが腸内環境改善に協調的・相乗的な作用を発揮しうること、それぞれの腸内細菌利用糖が腸内細菌(環境)に異なる影響を及ぼすことが明らかになった。
MACsには、難消化性多糖・オリゴ糖、難吸収性糖など、多様なものがあり、これらを栄養源として利用できるかは、それぞれの腸内細菌によって異なる。そのため、MACsが腸内細菌叢および宿主の生理機能に与える影響は、それぞれの腸内細菌利用糖によって異なる。
適切なMACsを摂取することで、個人に応じた腸内環境を構築できる可能性が示唆された。
研究は、慶應義塾大学大学院薬学研究科修士課程の冨岡佐和子(研究当時)、慶應義塾大学薬学部の関夏実特任助教(研究当時)、金倫基教授を中心とする研究グループによるもの。研究成果は、国際学術誌「Cell Reports」にオンライン掲載された。
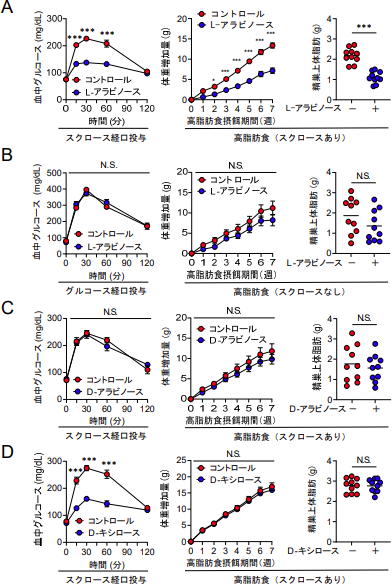
(左) 24時間絶食後、L-アラビノース(アラビノース)の投与下または非投与下でスクロースを経口投与したマウスの血糖値。
(中央・右) スクロースを含む高脂肪食を与えたマウスにL-アラビノースを投与した。
(中央) 体重増加、(右) 精巣上体白色脂肪組織の重量。
B
(左) 24時間絶食後、L-アラビノースの投与下または非投与下でグルコースを経口投与したマウスの血糖値。
(中央・右) スクロースを含まない(糖源がグルコースのみの)高脂肪食を与えたマウスにL-アラビノースを投与した。
(中央)体重増加、(右)精巣上体白色脂肪組織の重量。
C
(左) 24時間絶食後、D-アラビノースの投与下または非投与下でスクロースを経口投与したマウスの血糖値。
(中央・右) スクロースを含む高脂肪食を与えたマウスにD-アラビノースを投与した。
(中央)体重増加、(右)精巣上体白色脂肪組織の重量。
D
(左) 24時間絶食後、D-キシロースの投与下または非投与下でスクロースを経口投与したマウスの血糖値。
(中央・右) スクロースを含む高脂肪食を与えたマウスにD-キシロースを投与した。
(中央)体重増加、(右)精巣上体白色脂肪組織の重量。
それぞれのドットは、個々のマウスまたは平均±SEM。* p <0.05; *** p <0.001; N.S.有意差なし
慶應義塾大学 薬学部・薬学研究科
Cooperative action of gut microbiota-accessible carbohydrates improves host metabolic function (Cell Reports 2022年7月19日)











