心不全の再発と多病のメカニズムを解明 心不全のストレスが造血幹細胞に蓄積 腎臓病やサルコペニアにも関与 東大と千葉大
心不全の再発と多病のメカニズムを同定 ストレスが血液に蓄積
心不全は、糖尿病と併発することが多く、糖尿病は心不全のリスクを高める要因のひとつとされている。
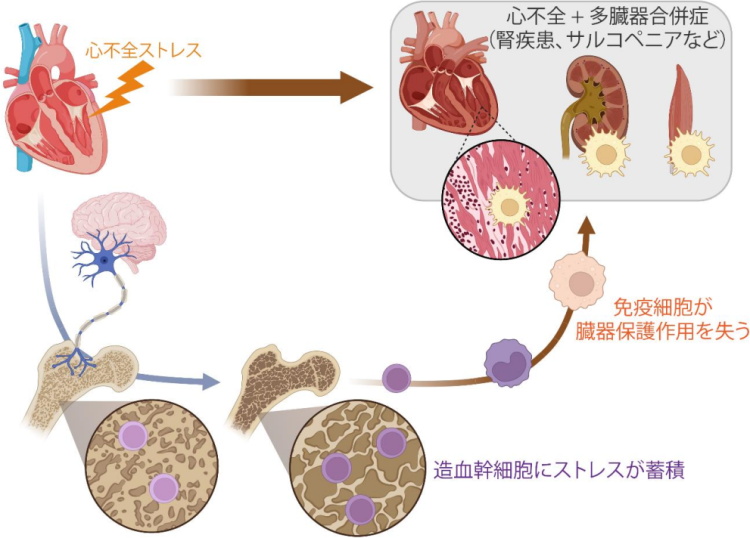
東京大学と千葉大学は、心不全の臨床経過の特徴である「一度心不全を発症すると、入退院を繰り返す(再発)」「他の病気にも影響する(多病)」に着目し、「心不全になると、そのストレスがどこかに蓄積する」と仮説を立てて研究を行った。
その結果、心不全になった際にストレスが骨のなかにある造血幹細胞に蓄積されることを世界ではじめて同定した。造血幹細胞は、心臓に対して心臓を保護する免疫細胞を供給するが、ストレスが蓄積している造血幹細胞はその保護的な免疫細胞をつくりだすことができず、これが心臓の機能悪化を引き起こし、再発しやすい原因となることを明らかにした。
研究グループはこれまで、心臓内の免疫細胞が心臓の収縮力を維持したり、不整脈を生じさせないようにするといった、心臓を保護する機能を有していることを報告してきた。
今回の研究で、造血幹細胞はこの心臓を保護する免疫細胞のもとになる細胞であり、ストレスが蓄積した造血幹細胞からは、心臓を保護する免疫細胞がつくられなくなり、その結果、心臓の保護作用が失われ機能が低下し、心不全が再発しやすい原因になることを明らかにした。
さらに、造血幹細胞は全身の臓器に免疫細胞を供給しており、この造血幹細胞へのストレスの蓄積によって、腎臓、骨格筋、脂肪組織などの免疫細胞にも悪影響を与え、心不全に合併し生命予後の悪化と関連する腎臓病、サルコペニア、るい痩の発症にも関与していることも解明した。
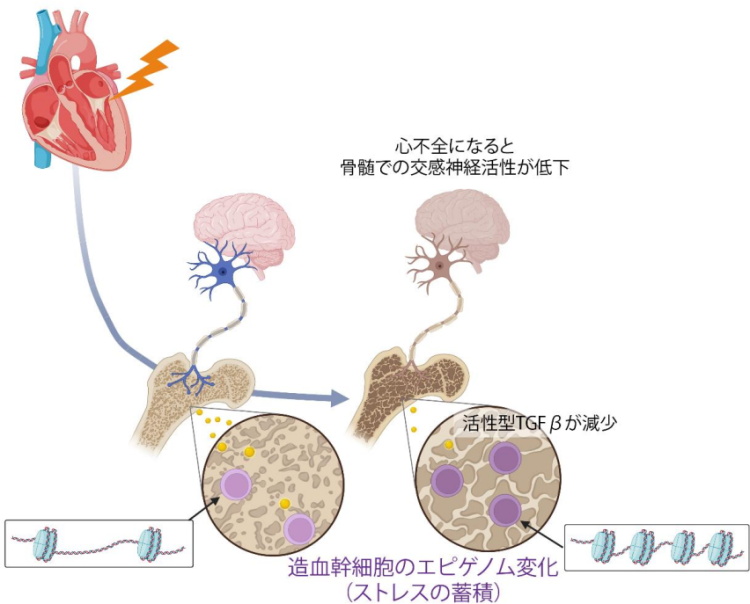
研究グループは、どのように造血幹細胞にストレスの蓄積が生じるかを検討した結果、心不全時に脳に伝わったストレスは、脳から骨のなかにある交感神経の機能低下を生じさせ、その交感神経の周囲に巻き付いているシュワン細胞から、健康なときには分泌されている活性型TGFβというタンパク質が分泌されなくなることを同定した。
活性型TGFβが骨のなかで不足すると、造血幹細胞の遺伝子発現を制御するエピゲノムに変化が生じ、これが心不全時のストレス蓄積の実態であることを突き止めた。
どのようにするとストレスの蓄積を予防できるかを検討した結果、心不全のモデル動物で、心不全時に骨のなかで不足する活性型TGFβを注射で補うと、ストレス蓄積を予防することができた。
研究は、東京大学大学院医学系研究科の藤生克仁特任教授と、小室一成特任教授(国際医療福祉大学副学長兼任)、千葉大学大学院医学研究院の眞鍋一郎教授らによる研究グループによるもの。研究成果は、「Science Immunology」に掲載された。
「研究成果は、心疾患による心不全死や心臓突然死の新しい予防法、治療法の開発に貢献することが見込まれるとともに、今後は心不全発症前の超早期発見や、発症前に治療を行う未来の治療につながることが期待される」と、研究者は述べている。
なお研究は、科学技術振興機構(JST)ムーンショット型研究開発事業「恒常性の理解と制御による糖尿病および併発疾患の克服」、日本医療研究開発機構(AMED)循環器疾患・糖尿病等生活習慣病対策実用化研究事業「心不全が惹起するサルコペニアの新しい発生機序の解明」、AMED革新的先端研究開発支援事業「心血管ストレスの新しい感知・統合機構による恒常性維持機構とその破綻機序の解明」、科研費基盤研究(A)「心臓内免疫細胞の機能異常と老化による心不全発症機序の解明」、基盤研究(B)「造血・免疫系による身体・精神ストレス受容と心不全・multimorbidity 発症機序の解明」の支援により実施された。
Heart failure promotes multimorbidity through innate immune memory (Science Immunology 2024年5月24日)












