週1回投与のデュアルGIP/GLP-1受容体作動薬「Tirzepatide」の第3相試験 2型糖尿病患者のHbA1cおよび体重を有意に減少
「Tirzepatide」は、主要評価項目および全ての主な副次評価項目を達成し、最高用量(15mg)でHbA1cを2.37%低下し、体重を12.9kg(13.9%)減少した。

GIPとGLP-1の両インクレチンの作用を統合した週1回投与デュアルGIP/GLP-1受容体作動薬
イーライリリー・アンド・カンパニーは、「Tirzepatide」とインスリンデグルデクの漸増投与を比較したSURPASS-3試験、およびインスリングラルギン漸増投与への追加療法として「Tirzepatide」とプラセボを比較したSURPASS-5試験のトップライン結果を公表した。2つのestimandを用いた評価のいずれでも、「Tirzepatide」は主要評価項目および全ての主な副次評価項目を達成した。
「Tirzepatide」は、2型糖尿病治療のために開発されている新しいクラスの治療薬であり、グルコース依存性インスリン刺激性ポリペプチド(GIP)とグルカゴン様ペプチド(GLP-1)の両インクレチンの作用を単一分子に統合した新規の週1回投与デュアルGIP/GLP-1受容体作動薬。
GIPは、GLP-1受容体作動薬の効果を補完するホルモンだ。前臨床モデルで、GIPは食物摂取量を減少させエネルギー消費を増加させることが示されているため、体重の減少をもたらすと考えられる。また、GLP-1受容体作動薬と併用することでグルコースと体重に対してより大きな効果をもたらす可能性がある。
Tirzepatideは、成人2型糖尿病患者の血糖値管理と慢性的体重管理のために第3相で開発中。また、非アルコール性脂肪肝炎(NASH)の治療薬としても研究されている。
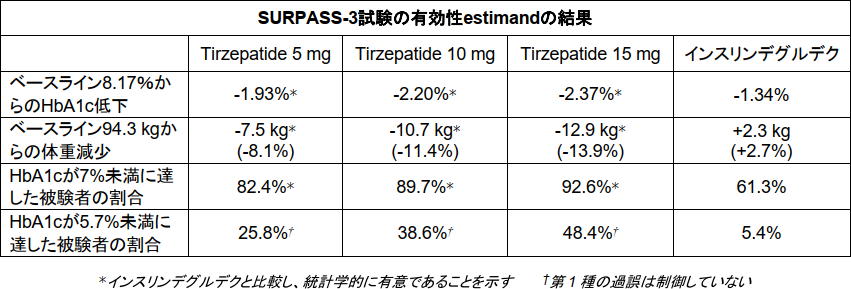
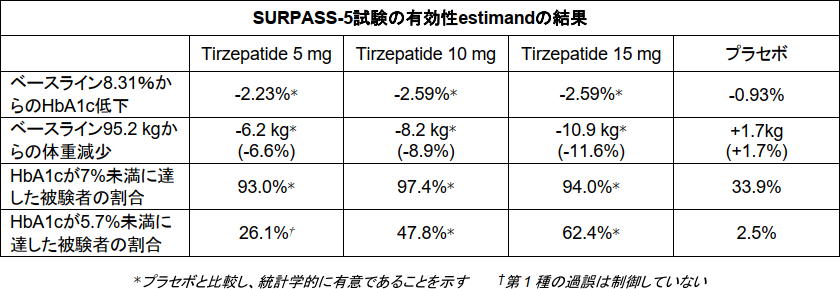
有効性estimandを用いた評価によると、「Tirzepatide」最高用量群(15mg)で、SURPASS-3試験ではHbA1cが2.37%低下し、体重が12.9kg(13.9%)減少、SURPASS-5試験ではHbA1cが2.59%低下し、体重が10.9kg(11.6%)減少したことが示された。
SURPASS-5試験の被験者の糖尿病の平均罹病期間は13.3年だったが、「Tirzepatide」最高用量群(15mg)の62.4%は糖尿病ではない人のレベルである5.7%未満のHbA1cに到達した。
「Tirzepatide」の両試験における全体的な安全性プロファイルは、これまでに確立されたGLP-1受容体作動薬と同様であり、消化器系の副作用が最も多く報告された有害事象だった。
低血糖発生率が低いまま、持続的なHbA1cの低下と体重減少を達成
SURPASS-3試験は、SGLT2阻害薬の併用の有無に関わらず、維持用量のメトホルミンでは血糖コントロールが不十分な成人2型糖尿病患者を対象に、「Tirzepatide」の3用量(5mg、10mg、15mg)の有効性および安全性をインスリンデグルデク漸増投与と比較した52週間の無作為化非盲検試験。被験者はインスリン療法を過去に受けたことがなく、糖尿病の平均罹病期間は8.4年、ベースラインのHbA1cは8.17%、ベースラインの体重は94.3kgだった。
同試験では、有効性estimandおよび治療方針estimandを用いた評価で、主要評価項目および主な副次評価項目を達成した。HbA1c低下および体重減少については、「Tirzepatide」の3用量(5mg、10mg、15mg)全ての群が、インスリンデグルデク漸増投与群(52週時の平均用量は1日48.8単位)に対する優越性を示した。
さらに、Tirzepatide群で最大92.6%が、HbA1c 7%未満(米国糖尿病学会が糖尿病患者に推奨する目標)に到達した。追加の副次的評価では、Tirzepatide群の被験者の最大48.4%が、HbA1c 5.7%未満に到達した。
治療方針estimandで、「Tirzepatide」の各用量はインスリンデグルデクの漸増投与群に対する統計学的に有意なHbA1c低下と体重減少を示した。
⚫ HbA1c低下:-1.85%(5mg)、-2.01%(10mg)、-2.14%(15mg)、-1.25%(インスリンデグルデク)
⚫ 体重減少:-7.0kg(5mg)、-9.6kg(10mg)、-11.3kg(15mg)、+1.9kg(インスリンデグルデク)
⚫ HbA1cが7%未満:79.2%(5mg)、81.5%(10mg)、83.5%(15mg)、58.0%(インスリンデグルデク)
54mg/dL未満の低血糖(レベル2)は「Tirzepatide」投与群で1.4%(5mg)、1.1(10mg)、2.2%(15mg)の被験者に認められ、インスリンデグルデク群で7.3%に認められた。
Tirzepatide群で最も多く報告された有害事象は概して軽度から中等度の消化器関連であり、多くは投与量の増量期間中に認められ、投与を続けると減少した。同試験の「Tirzepatide」投与群 (それぞれ5mg、10mg、15mgの順)では、 悪心 (11.5%、22.5%、23.7%)、下痢(15.4%、16.7%、15.6%)、嘔吐(5.9%、9.4%、10.0%)がインスリンデグルデク漸増投与群(悪心1.7%、下痢3.9%、嘔吐1.1%)に比べて多く認められた。
有害事象に起因する治療中止割合は、7.2% (5mg)、9.7%(10mg)、10.9%(15mg)、1.4%(インスリンデグルデク)だった。
オーストリア首都ウィーンのラントシュトラーセクリニックの准教授でSURPASS-3試験の治験責任医師であるBernhard Ludvik氏は次のように述べている。
「注射薬治療を受ける治療段階の2型糖尿病患者さんにとって、この結果はTirzepatideがHbA1c低下および体重減少に対して有益である可能性を示しています。1年にわたる試験を通して、糖尿病患者さんと臨床医にとって重要な考慮事項であるレベル2の低血糖発生率が低いまま、Tirzepatide」の持続的なHbA1cの低下と体重減少が認められました」。
SURPASS-5試験は、成人2型糖尿病患者を対象にメトホルミン併用の有無に関わらず、インスリングラルギン漸増投与への追加療法として、「Tirzepatide」の3用量(5mg、10mg、15mg)の有効性および安全性をプラセボと比較した40週間の無作為化二重盲検試験。被験者の糖尿病の平均罹病期間は13.3年、ベースラインのHbA1cは8.31%、ベースラインの体重は95.2kg、ベースラインのインスリングラルギンの平均用量は1日37.6単位だった。
同試験の有効性estimandおよび治療方針estimandを用いた評価で、主要評価項目および主な副次評価項目を達成した。HbA1c低下および体重減少については、「Tirzepatide」の3用量(5mg、10mg、15mg)全ての群がプラセボに対する優越性を示した。Tirzepatide群で最大97.4%の被験者が、HbA1c 7%未満に到達した。さらに、「Tirzepatide」の最高用量群(15mg)の62.4%の被験者が、HbA1c 5.7%未満に到達した。40週時点のインスリングラルギン平均用量は、プラセボより「Tirzepatide」全群で低く、それぞれ1日37.6単位(5mg)、1日35.7単位(10mg)、1日29.4単位(15mg)、1日58.8単位(プラセボ)だった。
治療方針estimandで、「Tirzepatide」の各用量はプラセボに対する統計学的に有意なHbA1c低下と体重減少を示した。
⚫ HbA1c低下:-2.11%(5mg)、-2.40%(10mg)、-2.34%(15mg)、-0.86%(プラセボ)
⚫ 体重減少:-5.4kg(5mg)、-7.5kg(10mg)、-8.8kg(15mg)、+1.6kg(プラセボ)
⚫ HbA1cが7%未満:87.3%(5mg)、89.6%(10mg)、84.7%(15mg)、34.5%(プラセボ)
54mg/dL未満の低血糖は「Tirzepatide」投与群で15.5%(5mg)、19.3%(10mg)、14.2%(15mg)の被験者に認められ、プラセボ群で12.5%認められた。
Tirzepatide群で最も多く報告された有害事象は概して軽度から中等度の消化器関連であり、多くは投与量の増量期間中に認められ、投与を続けると減少した。同試験のTirzepatide投与群(それぞれ5mg、10mg、15mgの順)では、悪心(12.9%、17.6%、18.3%)、下痢(12.1%、12.6%、20.8%)、嘔吐(6.9%、7.6%、12.5%)、便秘(6.0%、6.7%、6.7%)がプラセボ群(悪心2.5%、下痢10.0%、嘔吐2.5%、便秘1.7%)に比べて多く認められた。有害事象に起因する治療中止割合は、6.0% (5mg)、8.4%(10mg)、10.8%(15mg)、2.5%(プラセボ)だった。
SURPASS-3試験およびSURPASS-5試験の完全なデータはまだ評価されていないが、第81回米国糖尿病学会年次学術集会にて公表され、2021年に論文化される予定。










