膵β細胞異常の原因となるmRNAの分解を制御するタンパク質CNOT3を解明 糖尿病発症における重要な役割を担う
2020.09.02
沖縄科学技術大学院大学(OIST)は、ヒトの体の全身で発現しているタンパク質「CNOT3」が、膵β細胞の機能障害の原因となる遺伝子の発現を抑制しており、血糖値の制御に重要な役割を果たしていることを明らかにしたと発表した。
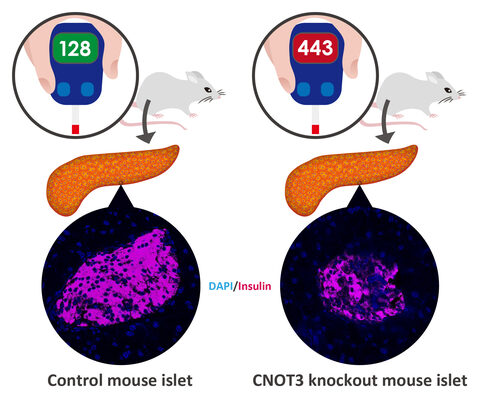
膵β細胞特異的CNOT3欠損マウスでは、インスリン産生が減少し、糖尿病を発症することを確認した。正常な膵β細胞の恒常性維持のために必要な分子機構を解明することで、糖尿病の新規の予防法と治療法を開発できる可能性がある。
膵β細胞特異的CNOT3欠損マウスでは、インスリン産生が減少し、糖尿病を発症することを確認した。正常な膵β細胞の恒常性維持のために必要な分子機構を解明することで、糖尿病の新規の予防法と治療法を開発できる可能性がある。

タンパク質CNOT3が糖尿病発症に関わるmRNAの発現を抑制
出典:沖縄科学技術大学院大学(OIST)、2020年
研究は、OIST細胞シグナルユニットのディナ モスタファ氏、栁谷朗子氏、山本雅教授、インペリアル カレッジ ロンドンのEleni Georgiadoud氏、Guy A. Rutter教授、理化学研究所生命医科学研究センターのYibo Wu氏と鈴木亨氏、ラフバラー大学のTheodoros Stylianides氏らの研究グループによるもの。研究成果は、科学誌「Communications Biology」に掲載された。
CNOT3は、全身の多くの臓器で発現し、各組織でさまざまな遺伝子を制御しているタンパク質。いくつかのメカニズムを介して適切な量のタンパク質を産生したり、特定の遺伝子の発現を抑制することで、細胞の生存や健康状態、機能維持に関与していると考えられている。
インスリンによって細胞はブドウ糖を取り込み、エネルギー源として利用するが、インスリンを生合成・分泌する膵β細胞の機能障害が起こると、インスリンが不足しブドウ糖は血液中に蓄積されるようになる。
膵β細胞は膵島にあるので、研究グループはまずマウス膵臓から採取した膵島の機能に着目し、糖尿病マウスと非糖尿病マウスでCNOT3の発現に違いがあるのかを調べた。その結果、糖尿病性膵島では非糖尿病性膵島と比較し、CNOT3のタンパク質量が大きく減少していることが分かった。
次に、CNOT3の膵β細胞特異的な生理機能を調べるために、CNOT3を膵β細胞特異的に欠損させたマウスを作製。このマウスでの糖代謝は、4週齢では正常に機能したが、8週齢では耐糖能障害を発症し、12週齢のマウスは重度な糖尿病を発症した。
CNOT3がない場合、正常な膵β細胞でスイッチがオフになっているはずのいくつかの遺伝子のスイッチがオンになり、タンパク質発現が増大すると考えられる。これらの遺伝子は一度スイッチが入ると、グルコース応答性インスリン分泌ができなくなってしまうなど、膵β細胞にあらゆる障害を引き起こすため、正常な膵β細胞では抑制されている。
この現象の分子メカニズムをさらに調べたところ、CNOT3と通常はスイッチオフされている遺伝子のメッセンジャーRNA(mRNA)との間に関連性があることが示された。mRNAは遺伝子配列に対応する一本鎖の分子であり、タンパク質の合成に不可欠だ。
正常な膵β細胞では、これらの遺伝子のmRNAはほとんど発現しないが、CNOT3が取り除かれると、これらmRNAがはるかに安定化することが判明。安定化したmRNAからはタンパク質が産生され、正常な膵β細胞の機能に好ましくない影響を与えていることを突き止めた。このことは、CNOT3がmRNAを不安定にすることで、これらの遺伝子がスイッチオフの状態に保たれている可能性を示している。
「この研究は、正常な膵β細胞の恒常性維持のために必要な分子機構の解明に向けた一歩であり、最終的には、糖尿病に対する新規予防法と治療法の開発に貢献する可能性があります」と、モスタファ氏は述べている。
沖縄科学技術大学院大学(OIST)細胞シグナルユニットLoss of β-cell identity and diabetic phenotype in mice caused by disruption of CNOT3-dependent mRNA deadenylation(Communications Biology 2020年8月28日)
[Terahata / 日本医療・健康情報研究所]











