【新型コロナ】SARS-CoV-2のスパイクタンパク質をブロックして感染を阻止 高い中和活性のあるタンパク質製剤の開発へ 大阪大学など
2020.11.20
大阪大学と京都府立医科大学の研究グループは、新型コロナウイルスの受容体であるACE2タンパク質のウイルス結合力を100倍以上高めることに成功したと発表した。
新型コロナウイルスは、ヒト細胞のACE2タンパクと結合することで感染するが、結合力を高めた高親和性改変ACE2タンパクを用いることで、ヒト細胞への感染を阻害できる可能性がある。
研究グループは今後、このタンパク質を用いたウイルス中和タンパク質製剤の創薬を行うとしている。
新型コロナウイルスは、ヒト細胞のACE2タンパクと結合することで感染するが、結合力を高めた高親和性改変ACE2タンパクを用いることで、ヒト細胞への感染を阻害できる可能性がある。
研究グループは今後、このタンパク質を用いたウイルス中和タンパク質製剤の創薬を行うとしている。
SARS-CoV-2のスパイクタンパク質をブロックして中和し感染を防ぐ
研究は、京都府立医科大学大循環器内科学の星野温助教、大阪大学蛋白質研究所の高木淳一教授、微生物病研究所の岡本徹教授らの研究グループによるもの。研究成果は、プレプリントリポジトリ「bioRxiv」に掲載された。 新型コロナウイルス(SARS-CoV-2)は、粒子表面にあるスパイクタンパク質が、ヒトの細胞表面にあるACE2タンパク質に結合することで感染が起こる。そのため、治療方法のひとつとして、スパイクタンパク質をブロックして中和する方法があり、現在この中和製剤として抗体製剤の開発が世界中で行われている。 しかし、抗体製剤ではウイルスの遺伝子変異によりスパイクの形状が変化して抗体が結合できなくなる「エスケープ変異」が起こると懸念されている。 エスケープ変異は、ウイルスが遺伝子を変異させることで、抗体や化合物の標的部位の形状を変化させ、結合できなくし薬剤耐性を獲得する変異。 研究グループは、この問題を克服するために、新型コロナウイルス受容体であるACE2タンパク質に着目し、ウイルスとの結合力を高めることで高い中和活性をもつタンパク質製剤の開発に取り組んだ。ACE2のウイルススパイクとの結合力を100倍以上に高めるのに成功
研究グループは、「指向性進化法」という、試験管内でACE2タンパク質をウイルスに結合しやすくなるように進化させる方法を用いた。指向性進化法は、自然界の進化にならって、DNAの突然変異誘発による多様化と選択のサイクルを繰り返すことで、自然界にはみられない高性能なタンパクを作出する技術。 まず、ACE2遺伝子をエラーが入りやすい条件で増幅させることで、約10万種類のACE2変異体ライブラリを作製。次に、それぞれの変異体を細胞表面に発現させてウイルスのスパイク成分とよく結合するものを回収した。 回収されたACE2変異体にさらに変異を導入し、同様の流れでよりスパイク成分と結合するものを回収。これを繰り返すことで最終的にACE2のウイルススパイクとの結合力を100倍以上に高めることに成功した。 結合力の指標である解離定数(KD値)は、野生型41.4nMに対し、改変ACE2で0.37nMと、抗体製剤と同等以上の結合力を達成した。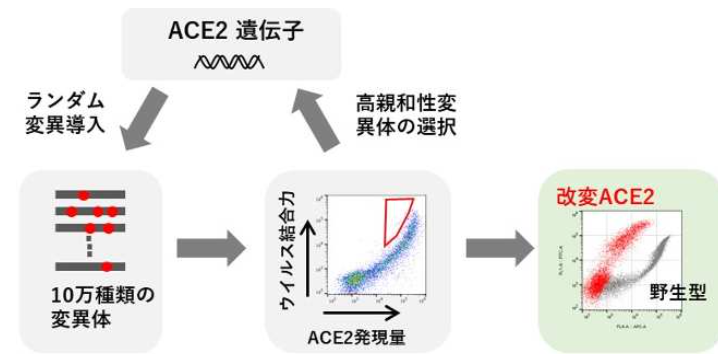
出典:大阪大学、2020年
新型コロナに対する良好な中和活性を確認
次に、この高親和性改変ACE2に抗体のFc領域を結合させたタンパク質製剤を合成し機能評価を行った。Fc領域は、免疫細胞や補体と結合することで、抗体が抗原と結合した後の免疫反応を媒介する。Fcを結合させることで体内での薬物動態が安定化することや、2量体になり中和活性が向上することが期待できる。 新型コロナウイルスよりも比較的安全なシュードウイルスを用いた中和実験では、各濃度のACE2-Fcとウイルスを293T/ACE2細胞と1時間反応させ、48時間後にルシフェラーゼアッセイ法により感染率を評価。50%感染阻害濃度(IC50)が野生型で12.6µg/mLであるのに対し、改変型は0.055µg/mLと約200倍の有効性を認めた。 また、新型コロナウイルスに対する中和実験では、一般的な抗体製剤の血中濃度領域で改変型ACE2-Fcで良好なウイルス中和活性が確認された。 シュードウイルスの中和試験では、各濃度のACE2-Fcとウイルスを293T/ACE2細胞と1時間反応させ、48時間後にルシフェラーゼアッセイ法により感染率を評価した。 新型コロナウイルス中和試験では各濃度のACE2-FcとウイルスをVero6/TMPRSS2細胞と2時間反応させ、24時間後に培地中に分泌されたウイルスコピー数をリアルタイムPCR法で評価した。COVID-19に終止符を打つことを期待
研究グループは、今回開発された高親和性改変ACE2タンパク質を用いて、高いウイルス中和活性を持ち、かつウイルスの遺伝子変異による薬剤耐性が問題とならない、新たなモダリティによる治療薬の開発に取り組むとしている。創薬は、生命科学インスティテュートと共同で行う。 「この製剤を、安全にヒトへ投与し普及させることができれば、世界を脅かしているCOVID-19に終止符を打つことが期待されます」と、研究グループは述べている。 研究は、京都府立医科大学大循環器内科学の星野温助教、大阪大学蛋白質研究所の高木淳一教授、微生物病研究所の岡本徹教授らの研究グループによるもの。研究成果は、プレプリントリポジトリ「bioRxiv」に掲載された。 京都府立医科大学 大学院医学研究科 循環器・腎臓内科学大阪大学 蛋白質研究所 分子創製学研究室
大阪大学 微生物病研究所 高等共創研究院
High affinity modified ACE2 receptors prevent SARS-CoV-2 infection(bioRxiv 2020年9月16日)
[Terahata / 日本医療・健康情報研究所]