高濃度の乳酸を代謝するメカニズムを解明 乳酸アシドーシスの病態解明に期待 京都府立医大
2020.09.09
京都府立医科大学のは、乳酸に反応して細胞質から核へと移行する分子「LRPGC1」を同定し、この分子が乳酸存在下でミトコンドリアを活性化することで乳酸代謝を促進することを発見した。

乳酸に反応して細胞質から核へと移行する分子「LRPGC1」を発見
乳酸の蓄積は致死性の乳酸アシドーシスを引き起こすおそれがあり、乳酸代謝を促進するメカニズムの解明は臨床的にも重要視されている。 過度な運動や代謝不全、悪性腫瘍、虚血などにより解糖によって生成された乳酸は大部分が肝臓によって代謝される。しかし、高濃度に蓄積された乳酸がどのように遺伝子発現を活性化させ、乳酸代謝が促進されるかについての分子メカニズムはよく分かっていなかった。 乳酸アシドーシスは致死率が数十%以上にも上る非常に危険な病態であり、血中乳酸値は予後とも密接に関連していることから、乳酸代謝を促進する方法の確立が求められている。 乳酸の代謝は70%近くが肝臓によって行われ、蓄積された乳酸は通常速やかに代謝されるが、体内で乳酸値が過度に上昇した際どのように遺伝子発現が調節され乳酸の代謝が活性化されるのかというメカニズムはよく分かっていなかった。 そこで研究グループは、乳酸に反応して細胞質から核へと移行する分子「LRPGC1」を同定。その細胞内局在を詳細に調べることで乳酸によって核移行するという特性を見出し、遺伝子ノックアウト細胞やモデルマウスなどを用いて乳酸代謝を促進するというLRPGC1の機能を突き止めた。 この研究成果により、乳酸が蓄積した際それに反応して遺伝子発現が活性化する仕組みが明らかになった。乳酸アシドーシスの病態解明と新たな治療法の開発につながることが期待される。 研究は、京都府立医科大学大学院医学研究科生体構造科学の谷田任司助教、松田賢一准教授、田中雅樹教授らの研究グループによるもの。研究成果は、米科学雑「The FASEB Journal」に掲載された。LRPGC1は乳酸存在下で転写因子ERRγと相互作用し、ミトコンドリアの活性化とそれによる乳酸代謝の促進を引き起こす
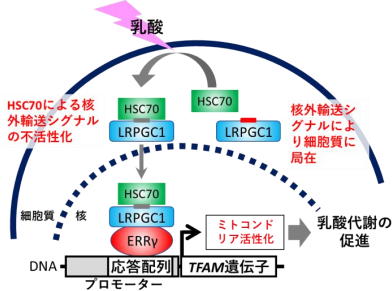
LRPGC1は、好気的代謝を活性化する分子として知られるPGC1αの新規スプライシングバリアント、すなわち同一遺伝子から生ずる異型体だ。細胞内での局在や動態はその分子の機能と密接に関わっているため、LRPGC1の機能を調べるために研究グループは、まず蛍光標識を行い、細胞内での局在を生細胞イメージングにより観察した。 すると、PGC1αは核に局在したのに対し、LRPGC1は細胞質に局在した。いくつかの刺激を与えてLRPGC1の動きを観察すると、乳酸を投与した際に劇的な核移行を起こすことが判明した。 そこで、この分子をlactic acid-responsive form of PGC1(LRPGC1)と名付けた。詳細な解析により、この核移行メカニズムには核外輸送シグナル(NES)が分子シャペロンHSC70によって不活性化されることによって起こることが示唆された。 機能解析を行ったところ、LRPGC1は乳酸存在下で転写因子であるエストロゲン関連受容体(ERRγ)と相互作用し、その転写活性を高めることが分かった。 肝腫瘍由来細胞株HepG2からPGC1遺伝子をCRISPR/CAS9によりノックアウト(遺伝子を欠損)すると乳酸代謝量は低下したが、従来知られていたPGC1αを導入しても乳酸代謝を回復させることはできなかった。一方、LRPGC1を導入するとPGC1ノックアウト細胞の乳酸代謝を回復させることができた。 ERRγ と相互作用できないLRPGC1の変異体を作製しPGC1ノックアウト細胞に導入しても乳酸代謝は回復されず、ERRγのノックダウン(遺伝子発現の抑制)によっても乳酸代謝は顕著に低下した。 つまり、LRPGC1はERRγを介して乳酸代謝を促進する分子であることが明らかになった。 LRPGC1による乳酸代謝のメカニズムを追究するために、エネルギー代謝に関する遺伝子発現を調べてみたところ、乳酸添加後にPGC1ノックアウト細胞では正常型HepG2細胞と比べミトコンドリアの活性に関わる遺伝子、とくにミトコンドリア転写因子A(TFAM)の発現が低下しており、ミトコンドリア形態も不全となっていることが分かった。 一方、乳酸存在下でのPGC1ノックアウト細胞におけるTFAM発現やミトコンドリアの形態はPGC1α の導入によっては回復せず、LRPGC1の導入によって回復し、ミトコンドリア膜電位もLRPGC1の導入により有意に高まることが分かった。 また、TFAM遺伝子のプロモーター(遺伝子発現の制御領域)上にERR応答配列が存在することを新たに見出し、この部位を介してLRPGC1/ERRγシグナルはTFAM遺伝子の発現を誘導することが判明した。 これらの結果から、乳酸存在下でLRPGC1はERRγを介してTFAM発現を誘導し、ミトコンドリアを活性化することが明らかとなった。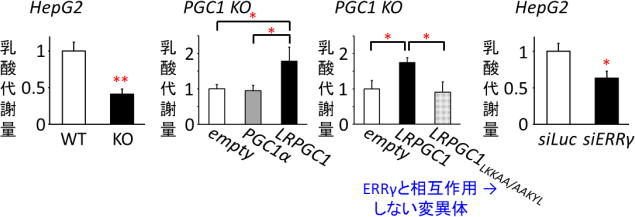
(左) 正常型(WT)とPGC1遺伝子をノックアウト(KO)したHepG2細胞とで、培地に添加した乳酸の代謝量を比較した。
(左中および右中) PGC1 KO細胞に図に示した遺伝子の発現ベクターを導入した際の乳酸代謝量を測定(empty: コントロールベクター)。
(右) 正常型HepG2細胞にsiRNAによる遺伝子ノックダウンを行った際の乳酸代謝量を測定(siLuc: コントロールsiRNA)。
(左中および右中) PGC1 KO細胞に図に示した遺伝子の発現ベクターを導入した際の乳酸代謝量を測定(empty: コントロールベクター)。
(右) 正常型HepG2細胞にsiRNAによる遺伝子ノックダウンを行った際の乳酸代謝量を測定(siLuc: コントロールsiRNA)。
出典:京都府立医科大学、2020年
LRPGC1/ERRγシグナルを活性化すると乳酸アシドーシスマウスの生存率が顕著に上昇
乳酸アシドーシスのモデルマウスを用いた検討では、Lrpgc1を肝臓でノックダウンすると致死率が上昇し、薬剤によりLRPGC1/ERRγシグナルを活性化すると生存性が有意に上昇することが明らかになった。 以上より、LRPGC1は通常NESの作用により細胞質に局在していますが、乳酸の曝露を受けるとHSC70によってNESが不活性化され核へと移行し、核内で転写因子ERRγと相互作用を起こした後TFAM遺伝子の発現を誘導、その結果ミトコンドリアの活性化による乳酸代謝の促進が起こる、というメカニズムが明らかとなった。 今回の研究で明らかとなったLRPGC1/ERRγシグナルを調節することにより、乳酸アシドーシスを治療する新たな方法につながることが期待される。 「今後は、敗血症や代謝障害など、より具体的な病態モデルに合併した乳酸アシドーシス対しLRPGC1/ERRγシグナルの活性化が役立つか否か、検証していく予定」と、研究グループは述べている。 京都府立医科大学 大学院医学研究科 生体構造科学Novel metabolic system for lactic acid via LRPGC1/ERRγsignaling pathway(The FASEB Journal: 2020年8月26日)
[Terahata / 日本医療・健康情報研究所]