自然発症型糖尿病モデルマウスの作製に成功 膵臓再生医療の新しい移植モデル動物として期待
2020.07.29
東京工業大学と熊本大学は、自然発症型糖尿病モデルマウスの作製に成功したと発表した。
ヒトiPS細胞やES細胞から作成された膵臓細胞の糖尿病治療効果を評価するための細胞移植実験への活用が期待される。
ヒトiPS細胞やES細胞から作成された膵臓細胞の糖尿病治療効果を評価するための細胞移植実験への活用が期待される。

iPS細胞やES細胞で作成した膵臓細胞の移植実験への活用を期待
東京工業大学と熊本大学の研究グループは、マウスのインスリン2タンパク質へのQ104del変異導入による自然発症型の糖尿病モデルマウスを作製した。 作製した糖尿病モデルマウスは、遺伝的な変異により発症するため、従来の薬剤投与による糖尿病モデルよりも安定に糖尿病を発症することができる。 そして、重度免疫不全モデルマウスの系統に遺伝子変異を導入したため、ヒトiPS細胞やES細胞から作成された膵臓細胞の糖尿病治療効果を評価するための細胞移植実験への活用が期待される。 この研究は、東京工業大学生命理工学院生命理工学系の粂昭苑教授、坂野大介助教、井上愛里大学院生らの研究グループが、熊本大学生命資源研究・支援センターの荒木喜美教授、同大ヒトレトロウイルス学共同研究センターの岡田誠治教授、順天堂大学大学院医学系研究科の小池正人教授らとの共同で行ったもの。研究成果は、英科学誌「Scientific Reports」にオンライン掲載された。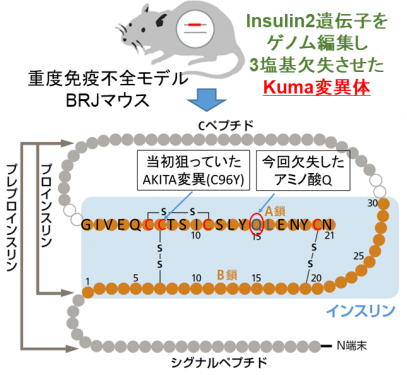
CRISPR/Cas9システムを用いて重篤な免疫不全BRJマウスに、変異の導入を試みた。
当初狙った相同組み換え体は得られなかったが、その代わり、遺伝子修復時に起こった3塩基DNAの欠失を有するマウス系統を得た。
このゲノム配列の欠失によりインスリン2タンパク質の104番目アミノ酸であるグルタミンが失われていた。
当初狙った相同組み換え体は得られなかったが、その代わり、遺伝子修復時に起こった3塩基DNAの欠失を有するマウス系統を得た。
このゲノム配列の欠失によりインスリン2タンパク質の104番目アミノ酸であるグルタミンが失われていた。
出典:熊本大学生命資源研究・支援センター、2020年
遺伝子変異糖尿病モデルはより安定した高血糖状態を作り出せる
膵臓β細胞は血糖の恒常性維持のためにインスリンを産生分泌する。血糖値を感知しインスリンを分泌する機能に関与するタンパク質群の遺伝子に変異があった場合に糖尿病を発症する。 従来、インスリン遺伝子において、生後すぐに糖尿病を引き起こすことで知られている変異がいくつか報告されていたが、今回は、新生児糖尿病変異の原因となる新規なインスリン遺伝子変異としてQ104del変異を同定した。 一方で、糖尿病の治療には膵臓移植または膵臓内のランゲルハンス島の移植が有効な治療手段だが、ドナー不足がその妨げになっている。そこでヒトiPS細胞やES細胞を膵臓細胞へ分化させ移植源とすることが期待されている。 試験管内で作製された膵臓細胞の糖尿病治療効果を評価するには、糖尿病モデル動物への細胞移植を行い、血糖値の改善効果によって評価することが有効な手法となる。 糖尿病モデルマウスを作製する方法としては、薬剤を使ってβ細胞を破壊する方法がよく使用されているが、研究グループは遺伝子変異糖尿病モデルの方が安定した高血糖状態を作り出せると考えた。 従来からよく使われている自然発症糖尿病モデルマウスは重篤な免疫不全の系統ではないため、ヒトの細胞の移植後の生着率を上げる必要があった。 そこで研究グループは、従来のモデルマウスと比べさらに重篤な免疫不全モデルであるBRJマウスのインスリン遺伝子に変異を導入した、重度免疫不全糖尿病モデルの作製に着手した。重度免疫不全のBRJマウスに遺伝子変異導入
BRJマウスは、BALB/cマウスのRag2遺伝子およびJak3遺伝子の両方を欠損させたマウスで、T細胞、B細胞、NK細胞が完全欠損し、NKT細胞が減少している、重度免疫不全マウス。2011年に熊本大学ヒトレトロウイルス学共同研究センターの岡田誠治教授らによって樹立された。 粂教授と荒木教授らは今回の研究で、ゲノム編集技術の1つであるCRISPR/Cas9システムを使用して、重度免疫不全マウスであるBRJマウスのInsulin2遺伝子を編集し、得られたマウスのなかにインスリン2タンパク質の104番目のアミノ酸であるグルタミンが欠失したマウスを作製した。 CRISPR/Cas9システムは、ウイルスやトランスポゾンが細胞内に侵入した場合の、細菌や古細菌で用いられる免疫適応の仕組みを利用したゲノム編集技術。Insulin2遺伝子は、β細胞でインスリンタンパク質を産生する2つの遺伝子(Insulin1、Insulin2)のうちの1つ。 このマウスは糖尿病の症状を示したことから、この変異型をKuma変異と名付けた。Kuma変異をもつマウス(Kumaマウス)は、生後4週以降に血糖値が上昇した。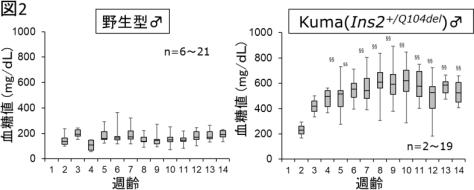
野生型マウスとKumaヘテロ接合体の各週齢におけるオスの随時血糖。
野生型マウスの血糖値は、100~200mg/dL程度であるが、Kumaマウスでは、3週齢ごろより血糖上昇が確認された。
野生型マウスの血糖値は、100~200mg/dL程度であるが、Kumaマウスでは、3週齢ごろより血糖上昇が確認された。
出典:熊本大学生命資源研究・支援センター、2020年
インスリン治療により正常な血糖値に回復
得られたKumaマウスの解析により、変異インスリンタンパク質の安定性が低く、生後3週以降にKumaマウスの膵臓β細胞におけるインスリンタンパク質の産生量が減少していたことが分かった。 そして、小池教授らの電子顕微鏡観察結果により、生後3週以降では、Kumaマウスの膵臓β細胞内のインスリン顆粒の数が減少していることが分かった。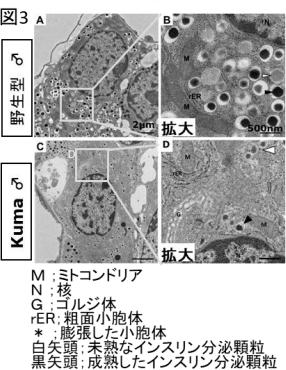
5週齢オスマウスの膵臓の電子顕微鏡観察像。Kumaマウスで、成熟したインスリン顆粒(黒矢頭)の数が少なくなっていた。
出典:熊本大学生命資源研究・支援センター、2020年
さらに成長とともに膵臓内のβ細胞が減少していく様子も観察された。これらの表現型の変化にともない、インスリンの分泌する能力は失われていくが、インスリンを徐々に放出するチップをマウス体内に入れ、インスリンを投与することで高血糖を是正できることを確認した。
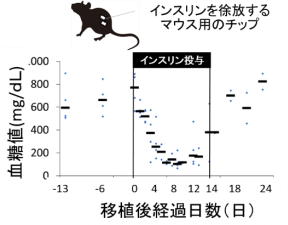
メスのKumaヘテロ接合体マウスにインスリン徐放チップを投与した。インスリン投与前後の血糖値を測定した。インスリン投与は8週齢から12週齢にかけて、4週間行った。
インスリン投与により、通常血糖(200mg/dL以下)まで高血糖は低下し、インスリン投与を停止する(チップの除去)と再び高血糖となった。
インスリン投与により、通常血糖(200mg/dL以下)まで高血糖は低下し、インスリン投与を停止する(チップの除去)と再び高血糖となった。
出典:熊本大学生命資源研究・支援センター、2020年
これらの結果から、インスリンを分泌するiPS細胞由来の膵臓細胞を移植し、糖尿病の治療効果を評価する動物モデルとしてこのKumaマウスが有用であることが明らかになった。
ヒトiPS細胞から血糖値に応じてインスリンを分泌できる膵臓細胞(iPS-β細胞)を高効率に作り出すことが、世界的に可能になりつつある。
研究グループは今後、「これらのiPS-β細胞を再生医療に利用し、長期間の治療効果を発揮できるかどうかを判断するためKumaマウスへの細胞移植実験を進める」としている。
東京工業大学 生命理工学院 生命理工学系熊本大学 生命資源研究・支援センター
Insulin2 Q104del (Kuma) Mutant Mice Develop Diabetes with Dominant Inheritance(Scientific Reports 2020年7月22日)
[Terahata / 日本医療・健康情報研究所]